
题目列表(包括答案和解析)
(15分)、对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA H++A―,则K=
H++A―,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
回答下列问题:
(1)当升高温度时,K值____(填“变大”“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系? ____ ________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、
H2PO4-、HPO42-都看做是酸,其中酸性最强的是_ ,最弱的是_ __。
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是_____________,产生此规律的原因是_____________ ___。
(5) Na2CO3溶液呈_ _(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是_ 。
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)____c(HPO42-)(填“大于”或“小于” )。
(15分)、对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA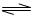 H++A―,则K=
H++A―,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。

回答下列问题:
(1)当升高温度时,K值____(填“变大”“变小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系? ____ ________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、
H2PO4-、HPO42-都看做是酸,其中酸性最强的是_ ,最弱的是_ __。
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是_____________,产生此规律的原因是_____________ ___。
(5) Na2CO3溶液呈_ _(填“酸性”“碱性”或“中性”),其原因(用离子方程式表示)是_ 。
(6)已知NaH2PO4溶液呈酸性,则该溶液中c(H3PO4)____c(HPO42-)(填“大于”或“小于” )。
 H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA![]() H++A―,则K==
H++A―,则K==![]() 式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH | 1.76×10―5 |
| H2CO3 | H2CO3 HCO3― | K1==4.31×10―7 K2==5.61×10―11 |
| H2S | H2S HS― | K1==9.1×10―8
K2==1.1×10―12 |
| H3PO4 | H3PO4 H2PO4― HPO42― |
K1==7.52×10―3 K2==6.23×10―8 K3==2.20×10―13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?___
__________________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是__________,最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是_______
____________________________。
(08广东六校三模) 对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。若25℃时有HA![]() H++A―,则K==
H++A―,则K== 式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25℃)。
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 1.76×10―5 |
H2CO3 | H2CO3 HCO3― | K1==4.31×10―7 K2==5.61×10―11 |
H2S | H2S HS― | K1==9.1×10―8 K2==1.1×10―12 |
H3PO4 | H3PO4 H2PO4― HPO42― | K1==7.52×10―3 K2==6.23×10―8 K3==2.20×10―13 |
回答下列各题:
(1)K只与温度有关,当温度升高时,K值__________(填“增大”、“减小”、“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是___最弱的是_____________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是________________,产生此规律的原因是___________________________________
1、B 2、C 3、D 4、A 5、D 6、A 7、D 8、C 9、AC 10、D 11、D 12、BD 13、AB 14、A
15.(12分)
1、(1)Br2;Fe3+ (每空2分,共4分)
(2)假设1方案:向黄色溶液加入CCl4,振荡,静置,下层溶液呈橙红色。(2分)
假设2方案:向黄色溶液滴加KSCN溶液,溶液变为(血)红色 (2分)
2、假设2 (1分);不可行(1分);因为Br2和Fe3+都能把I―氧化成I2使溶液都变蓝,无法得出结论。(2分)
3、2 Fe2+ + 4 Br- + 3Cl2 == 2 Fe3+ +2 Br2 + 6Cl- (2分)
16、
17、各元素分别为A :H B :O C: Na D:S
各物质为
a:SO2
b:SO
18.(10分)
(1)SO2 NH4+ (各2分,共4分)
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- (2分) 4NH3+3Cl2=NCl3+3NH4Cl (2分)
(3)饱和H水溶液中存在平衡:Cl2+H2O H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
19(10分)(1)①②④ (2)羧基 碳碳双键
 20.(1)① 1(2分);672(2分)② 0.56(2分)
20.(1)① 1(2分);672(2分)② 0.56(2分)
(2)520∽787(2分)
(3)见右图(4分,部分正确酌情给分)
八、本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分。
(1)I.IIIA (1分)
II.IVA (1分);b;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水。 (1分)
(2)I.3d24S2 (2分)
II.①BaTiO3 (2分) 6 (2分)
②[TiCl(H2O)5]Cl2 ?H2O(3分)
21.B⑴2NH3
+ 3CuO  3Cu +
N2 + 3H2O
。
3Cu +
N2 + 3H2O
。
⑵利用NaOH的碱性和遇水放热的性质,使NH3?H2O 分解后逸出 。
⑶ C (填序号);
⑷黑色固体变成了亮红色 。
⑸吸收多余的NH3 ;
⑹
⑺减少 ,因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加。
本资料由《七彩教育网》www.7caiedu.cn 提供!
本资料来源于《七彩教育网》http://www.7caiedu.cn
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com