
题目列表(包括答案和解析)

①B分子中没有支链。?
②D能与碳酸氢钠溶液反应放出二氧化碳。?
③D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。?
④F可以使溴的四氯化碳溶液褪色。?
(1)B可以发生的反应有_________ (选填序号)。?
①取代反应?②消去反应 ③加聚反应?④氧化反应
(2)D、F分子所含的官能团的名称依次是__________ 、__________。?
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式:__________________________________________________________________。
(4)E可用于生产氨苄青霉素等。已知E的制备方法不同于其常见的同系物,据报道,可由2-甲基-1-丙醇和甲酸在一定条件下制取E。该反应的化学方程式是_____________________________________________________________________。
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
(1)有机物A由C、H、O三种元素组成,其蒸气密度是同温同压下氢气密度的23倍,核磁共振氢谱显示其分子中有3种氢原子且个数比为3:2:1 。有机物A的分子式为 。
(2)芳香化合物B的分子式为C7H8O,B能与金属钠反应,不与强碱反应。B中所含官能团的名称 ;B的同分异构体中能与FeCl3溶液发生显色反应的物质有多种,请任写一种结构简式 。
(3)用A和B为原料完成以下转化:

已知:①两个醛分子间能发生如下反应:
 (﹣R、﹣R’表示氢原子或烃基)
(﹣R、﹣R’表示氢原子或烃基)

③1mol H分别与足量的金属钠、碳酸氢钠溶液反应时,均生成22.4L气体(标准状况)。
回答下列问题:
① C + D E的反应类型为 ;E
E的反应类型为 ;E F反应的反应类型为____________。
F反应的反应类型为____________。
②F的结构简式为: 。
③写出下列转化的化学方程式:
B D
。
D
。
D K
。
K
。
H I
。
I
。
④满足下列条件的F有多种同分异构体,
Ⅰ. 该物质和FeCl3溶液能发生显色反应;
Ⅱ.该物质能使Br2的CC14溶液褪色;
Ⅲ.该物质分子中只有一个甲基。
写出其中苯环上取代基数目不同的任意两种同分异构体的结构简式 。
(8分)某有机物A的结构简式为: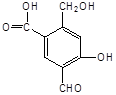
(1)A与过量的NaOH溶液反应时,A与参加反应的NaOH的物质的量之比是 。
(2)A与新制Cu(OH)2反应时,A与被还原的Cu(OH)2的物质的量之比是 。1molA最多能消耗 mol Cu(OH)2。
(3)A与过量的NaHCO3反应时,A与NaHCO3的物质的量之比是 。
(15分)PET是世界上产量最大的合成纤维,其结构简式为:
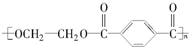
现以煤的干馏产品A与F为原料制备PET,生产的工艺流程如图所示。其中A为烃,含碳元素的质量分数为90.6%,其蒸气密度是空气密度的3.66倍,且能使酸性高锰酸钾溶液褪色,但不能使溴水褪色。M分子里所有原子共平面。
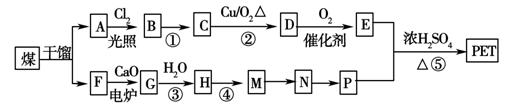
请回答下列问题:
(1)A的分子式为:________,下列反应类型为:M―→N________;反应⑤________。
(2)反应①的反应条件为:________;A的名称为________。
(3)写出有机物A所有一氯代物的结构简式:
________________________________________________________________________。
(4)写出下列反应的化学方程式:
反应③:_______________________________________________________________;
D与足量的氢氧化铜悬浊液煮沸:____________________________________________;
(5)P的一种同系物X的分子式为C3H8O2,在核磁共振氢谱图中出现三种信号峰,其峰的强度之比为2∶1∶1。则X的结构简式为_________________。
1、B 2、C 3、D 4、A 5、D 6、A 7、D 8、C 9、AC 10、D 11、D 12、BD 13、AB 14、A
15.(12分)
1、(1)Br2;Fe3+ (每空2分,共4分)
(2)假设1方案:向黄色溶液加入CCl4,振荡,静置,下层溶液呈橙红色。(2分)
假设2方案:向黄色溶液滴加KSCN溶液,溶液变为(血)红色 (2分)
2、假设2 (1分);不可行(1分);因为Br2和Fe3+都能把I―氧化成I2使溶液都变蓝,无法得出结论。(2分)
3、2 Fe2+ + 4 Br- + 3Cl2 == 2 Fe3+ +2 Br2 + 6Cl- (2分)
16、
17、各元素分别为A :H B :O C: Na D:S
各物质为
a:SO2
b:SO
18.(10分)
(1)SO2 NH4+ (各2分,共4分)
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- (2分) 4NH3+3Cl2=NCl3+3NH4Cl (2分)
(3)饱和H水溶液中存在平衡:Cl2+H2O H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
19(10分)(1)①②④ (2)羧基 碳碳双键
 20.(1)① 1(2分);672(2分)② 0.56(2分)
20.(1)① 1(2分);672(2分)② 0.56(2分)
(2)520∽787(2分)
(3)见右图(4分,部分正确酌情给分)
八、本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分。
(1)I.IIIA (1分)
II.IVA (1分);b;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水。 (1分)
(2)I.3d24S2 (2分)
II.①BaTiO3 (2分) 6 (2分)
②[TiCl(H2O)5]Cl2 ?H2O(3分)
21.B⑴2NH3
+ 3CuO  3Cu +
N2 + 3H2O
。
3Cu +
N2 + 3H2O
。
⑵利用NaOH的碱性和遇水放热的性质,使NH3?H2O 分解后逸出 。
⑶ C (填序号);
⑷黑色固体变成了亮红色 。
⑸吸收多余的NH3 ;
⑹
⑺减少 ,因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加。
本资料由《七彩教育网》www.7caiedu.cn 提供!
本资料来源于《七彩教育网》http://www.7caiedu.cn
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com