
题目列表(包括答案和解析)
(1)当生成沉淀的质量刚好最大时,消耗CO2的体积224 mL(标准状况)。在下图所示的坐标系中,画出生成沉淀的质量(m)与通入CO2的体积(V)的关系图。图中,生成沉淀的最大质量为_____________g,沉淀刚好全部溶解时消耗CO2的体积为_____________mL,混合物中KOH的质量为_____________g。
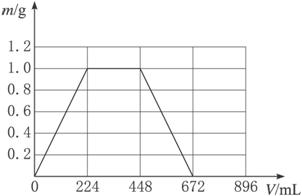
(2)若KOH和Ca(OH)2以任何比例混合,总质量仍保持1.3 g不变,则消耗CO2的总体积 V 的取值范围为___________mL<V<___________mL。
(14分) 二氧化碳又名碳酸气,具有较高的民用和工业价值,在多种领域有着广泛的应用。目前,二氧化碳在棚菜气肥、蔬菜(肉类)保鲜、生产可降解塑料等领域也展现良好的发展前景。二氧化碳是一种无色无味的气体,无毒、不导电并且没有可燃性。但是金属镁在点燃的条件下可以在二氧化碳气体中燃烧。其中还原产物是碳。
Ⅰ.①氧化产物是
②请写出化学反应方程式,并用双线桥法表示该反应的电子转移总数
Ⅱ.CO2气体与碱溶液反应时,用量不同其生成的产物不同。
取两份等物质的量浓度等体积的Ca(OH)2的溶液,一份通入过量CO2,生成沉淀的物质的量(n)和通入CO2体积(V)的关系如图所示
写出沉淀变化由a到b的离子方程式:
Ⅲ.另一份先加入少量的KOH固体溶解,再将过量CO2通入KOH和Ca(OH)2的混合溶液中,请绘图表示出生成沉淀的物质的量(n)和通入CO2体积(V)的关系;
并写出与上图中不同曲线处对应的离子反应方程式 ;
。

(1)原混合溶液中KOH的物质的量浓度为_____________mol/mL,250mL溶液中含Ca(OH)2的质量为_________g。
(2)写出A—B这段所发生的反应的离子方程式:_____________________________________
(3)图中V2为_________mL,V3为_________mL。

图3-7
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、检验装置气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是___________________________。装置A中试剂是________________。
③能说明碳的非金属性比硅强的实验现象是________________________________________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①在(1)①操作后打开b,关闭a。
②H2S溶液中有浅黄色浑浊出现,化学方程式是______________________________________。
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
|
|
写出其中SO2显示还原性并生成沉淀的离子方程式__________________________________。
④将KOH和Ca(OH)2的混合物1.3g全部溶于一定量水中形成稀溶液,再缓缓通入一定量的B气体,实验过程中可得到沉淀的最大质量为1.2g。
试计算:原混合物中KOH的质量为_____________g。生成沉淀质量为最大时,消耗B气体(标准状况下)的体积(V)范围是:_____________________________________。
1、B 2、C 3、D 4、A 5、D 6、A 7、D 8、C 9、AC 10、D 11、D 12、BD 13、AB 14、A
15.(12分)
1、(1)Br2;Fe3+ (每空2分,共4分)
(2)假设1方案:向黄色溶液加入CCl4,振荡,静置,下层溶液呈橙红色。(2分)
假设2方案:向黄色溶液滴加KSCN溶液,溶液变为(血)红色 (2分)
2、假设2 (1分);不可行(1分);因为Br2和Fe3+都能把I―氧化成I2使溶液都变蓝,无法得出结论。(2分)
3、2 Fe2+ + 4 Br- + 3Cl2 == 2 Fe3+ +2 Br2 + 6Cl- (2分)
16、
17、各元素分别为A :H B :O C: Na D:S
各物质为
a:SO2
b:SO
18.(10分)
(1)SO2 NH4+ (各2分,共4分)
(2)2Fe2++ Cl2=2 Fe3+ + 2Cl- (2分) 4NH3+3Cl2=NCl3+3NH4Cl (2分)
(3)饱和H水溶液中存在平衡:Cl2+H2O H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2分)
19(10分)(1)①②④ (2)羧基 碳碳双键
 20.(1)① 1(2分);672(2分)② 0.56(2分)
20.(1)① 1(2分);672(2分)② 0.56(2分)
(2)520∽787(2分)
(3)见右图(4分,部分正确酌情给分)
八、本题分A、B两题,考生只要选择其中一题作答。若两题都作答,则以A题得分计入总分。本题共12分。
(1)I.IIIA (1分)
II.IVA (1分);b;a点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水。 (1分)
(2)I.3d24S2 (2分)
II.①BaTiO3 (2分) 6 (2分)
②[TiCl(H2O)5]Cl2 ?H2O(3分)
21.B⑴2NH3
+ 3CuO  3Cu +
N2 + 3H2O
。
3Cu +
N2 + 3H2O
。
⑵利用NaOH的碱性和遇水放热的性质,使NH3?H2O 分解后逸出 。
⑶ C (填序号);
⑷黑色固体变成了亮红色 。
⑸吸收多余的NH3 ;
⑹
⑺减少 ,因为由NH3带出的水蒸气进入D装置,导致H原子的个数增加。
本资料由《七彩教育网》www.7caiedu.cn 提供!
本资料来源于《七彩教育网》http://www.7caiedu.cn
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com