
题目列表(包括答案和解析)
CuSO4·5H2O![]() CuSO4+5H2O
CuSO4+5H2O
CuSO4![]() CuO+SO3
CuO+SO3
4CuO![]() 2Cu2O+O2
2Cu2O+O2
2SO3![]() 2SO2+O2
2SO2+O2
试讨论胆矾晶体受热分解的相关问题。
(1)取一定量硫酸铜晶体(CuSO4·xH2O)置于已知质量的坩埚中称重,测得硫酸铜晶体的质量为a g。用酒精灯将坩埚充分加热,然后放入干燥器中冷却,再称重。经多次加热、冷却称重,直到质量基本不变,测得坩埚中剩余固体物质的质量为b g。
①该晶体中x的实验值为_______________。
②将实验值与根据化学式(CuSO4·5H2O)计算的结果比较,实验值大于计算值。造成误差的原因可能是_______________。
a.实验中部分固体溅出 b.加热温度过高 c.部分样品已风化
(2)另取25.0 g胆矾(CuSO4·5H2O),缓慢升温至1 000 ℃,
①在加热过程中,当固体物质的质量为10.0 g时,该固体可能的组成是(用化学式表示)____________________________________________________________。
②在1000 ℃时,除水外,其余气态产物物质的量(n)的取值范围是(不考虑实验误差)____________________________________________________________。
CuS04·5H2O![]() CuSO4+5H2O
CuSO4+5H2O
CuSO4![]() CuO+SO3
CuO+SO3
4CuO![]() 2Cu2O+O2
2Cu2O+O2
2SO3![]() 2SO2+O2
2SO2+O2
试讨论胆矾晶体受热分解的相关问题。
(1)取一定量硫酸铜晶体(CuSO4·xH2O)置于已知质量的坩埚中称重,测得硫酸铜晶体的质量为a g。用酒精灯将坩埚充分加热,然后放入干燥器中冷却,再称重。经多次加热、冷却称重,直到质量基本不变,测得坩埚中剩余固体物质的质量为b g。
①该晶体中x的实验值为___________________。
②将实验值与根据化学式(CuSO4·5H2O)计算的结果比较,实验值大于计算值,造成误差的原因可能是________________。
A.实验中部分固体溅出 B.加热温度过高 C.部分样品已风化
(2)另取25.0 g胆矾(CuSO4·5H2O),缓慢升温至1000℃。
①在加热过程中,当固体物质的质量为10.0 g时,该固体可能的组成是(用化学式表示)__________。
②在1000℃时,除水外,其余气态产物物质的量(n)的取值范围是(不考虑实验误差)______________。
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
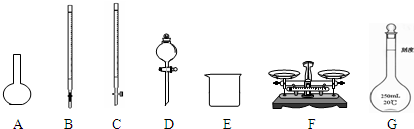
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。

(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。

(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com