
题目列表(包括答案和解析)



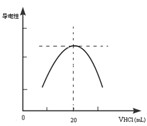 某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.请回答:(8分)DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某研究性学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
⑴用_______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
⑵量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(见左下图),向烧杯中滴加浓度为0.1000mol/L的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。
①用滴定管盛氨水前,滴定管要用_________润洗2~3遍,润洗的目的是____________。
②氨水与醋酸反应的离子方程式是__________________________________________。
③食用白醋中醋酸的物质的量浓度是_____________。
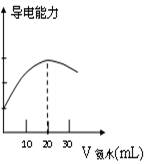
(8分)DIS系统即数字化信息系统,它由传感器、数据采集器和计算机组成,某研究性学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
⑴用_______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
⑵量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(见左下图),向烧杯中滴加浓度为0.1000mol/L的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。
①用滴定管盛氨水前,滴定管要用_________润洗2~3遍,润洗的目的是____________。
②氨水与醋酸反应的离子方程式是__________________________________________。
③食用白醋中醋酸的物质的量浓度是_____________。
(8分)DIS系统即数字化信息 系统,它由传感器、数据采集器和计算机组成,某研究性学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
系统,它由传感器、数据采集器和计算机组成,某研究性学习小组用DIS系统测定食用白醋中醋酸的物质的量浓度,以溶液的导电能力来判断滴定终点。实验步骤如下:
⑴用_______________(填仪器名称)量取10.00mL食用白醋,在_________(填仪器名称)中用水稀释后转移到100mL___________(填仪器名称)中定容,然后将稀释后的溶液倒入试剂瓶中。
⑵量取20.00mL上述溶液倒入烧杯中,连接好DIS系统(见左下图),向烧杯中滴加浓度为0.1000mol/L的氨水,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线(见右下图)。
①用滴定管盛氨水前,滴定管要用_________润洗2~3遍,润洗的目的是____________。
②氨水与醋酸反应的离子方程式是_ ________________________
________________________ _________________。
_________________。
③食用白醋中醋酸的物质的量浓度是_____________。
1、B 2、D 3、B 4、C 5、D 6.D 7.D 8.A 9.B 10.A 11.A 12.B 13.D
14、C 15、ACD 16、B 17、C 18、A 19、D 20、A 21、CD
22. (1)C ; 0.600 ;(2)0.92;2.76;7.22;6.78(3)(1)BCE (2)4.3
23.

 2424.
2424.
24.解:当加速电压为U1时电子到达O点速度为
 ,则
,则 =
= ① (2分)
① (2分)
电子在偏转电场时有 ② (2分)
② (2分)
 ③(1分)
③(1分)
当加速电压为U2时电子到达O点速度为
 ,则
,则 ④(2分)
④(2分)
电子刚飞出偏转时偏移量: ⑤(2分)
⑤(2分)  ⑥(1分)
⑥(1分)
如图,由三角形相似有 ⑦ (4分)
⑦ (4分)
所以  (2分)
(2分)  (2分)
(2分)
25.(1)A与B第一次碰前: (2分)
(2分)
A与B第一次碰撞  (2分)
(2分)
 (2分)
(2分)
所以
 (2分)
(2分)
(2)B、C第一次碰撞  所以
所以 即B碰后停下 (2分)
即B碰后停下 (2分)
BC第一次碰前 (2分)
(2分)
此时 (2分)
(2分)
AB第一次碰后到第二次相碰前  (2分)
(2分)
所以 (2分)
(2分)
第二次相碰前 =
= (2分)
(2分)
W= (2分)
(2分)
26.(10分)
⑴ F Al (各2分) ⑵  (3分)
(3分)
⑶ 2Al + 2OH― + 2H2O=2AlO2― + 3H2↑(3分)
27.(20分)
⑴ C D(2分)
⑵ A D(2分)
⑶ 压强更高,所需动力更大,对材料的强度和设备的制造要求也更高。(2分)
⑷ 合成氨反应是可逆反应,实际消耗的N2(或H2)少于10 mol(或30 mol)(2分)
⑸①将注射器取下置于盛水的水槽中,若水进入注射器,气体体积减少,则说明有氨气生成。(2分)
② A B D(2分)
⑹①上述待测氨水 确保氨水的浓度不发生改变(各1分)
② 0.6250 mol/L(2分)
③ A C (1分)
⑺ N2 + 6e―=2N3―(2分)
28.(18分)
⑴  (各2分) ⑵ NaNH2 + NH4Cl=NaCl +
2NH3 (2分)
(各2分) ⑵ NaNH2 + NH4Cl=NaCl +
2NH3 (2分)
⑶ ①②(各2分)
⑷  (3分) ⑸ 4 (2分) ⑹ 1
(2分)
(3分) ⑸ 4 (2分) ⑹ 1
(2分)
⑺ C6H15N3 O 3 + NH3→C6H12N4 + 3H2O(2分)
29.(12分)
⑴ ①②④(2分)
⑵ 羧基 碳碳双键(各2分)
⑶ (CH3)2 CHCH
⑷(CH3)2 CHCH2 O H+ HC O O H→(CH3)3 CC O O H +H2 O(2分)
30.(22分)
⑴CO2(2分)
⑵B处O2多于D处,D处CO2多于B处(2分)
⑶减少(2分) 增加(2分) 上升(2分)
⑷装置中CO2量越来越少,暗反应下降,导致ATP和NADPH积累,进而使光反应下降。(2分) 乳酸(2分)
⑸15NH3→氨基酸及蛋白质(或含15N的有机物)(2分)根瘤菌、大豆(2分)脱氨基(2分)
肝脏(1分) 尿素(1分)
Ⅱ.(8分)
⑴细胞核(1分) 蒸馏水(1分) 不同浓度的NaCl溶液(1分)
⑵核糖体、线粒体(2分)
⑶胰岛素(1分)
 ⑷骨髓中的造血干细胞
抗体(2分)
⑷骨髓中的造血干细胞
抗体(2分)
⑸⑼答案见右图。(2分)注:①缺少细胞膜、中心体、纺锤体或染色体数目不符等错误均不得分。②姐妹染色体形态应一致,每一条染色体的“两臂”应“甩向”赤道板,否则不得分。右图的“美观性”不作要求。
31.(12分)
⑴①实验前要先测定甲、乙鼠的体温 ②实验要有重复性,仅用两只小白鼠进行实验有一定的偶然性。③增加丙组与甲鼠处理方法相同但不破坏下丘脑。
⑵赞同。先做不破坏下丘脑的实验,再做破坏下丘脑后的实验,进行自身前后对照(2分)
⑶BD AC (2分,缺一不给分)
⑷甲状腺激素和肾上腺素(2分,缺一不给分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com