(1)除去铁粉中混有的铝粉可以选用的试剂为
B
B
(填序号).
A.稀盐酸 B.氢氧化钠溶液 C.浓硫酸
(2)为了检验某未知溶液是否是FeCl
2溶液,一位同学设计了以下实验方案加以证明.
方案:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液是FeCl
2溶液.回答以下问题:
你认为此方案是否合理
不合理
不合理
(填“合理”或“不合理”),若不合理,要检验Fe
2+应如何操作
向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子
向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子
.(若填“合理”,则此空可不答)
(3)现向一支装有FeCl
2溶液的试管中滴加氢氧化钠溶液,可观察到的现象是
白色絮状沉淀
白色絮状沉淀
→
迅速变成灰绿色
迅速变成灰绿色
→
最终变成红褐色
最终变成红褐色
,有关化学方程式为
FeCl2+2NaOH=Fe(OH)2↓+2NaCl
FeCl2+2NaOH=Fe(OH)2↓+2NaCl
;
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.
(4)向装有FeCl
2溶液的试管中通入Cl
2的化学反应方程式为:
2FeCl2+Cl2=2FeCl3
2FeCl2+Cl2=2FeCl3
.

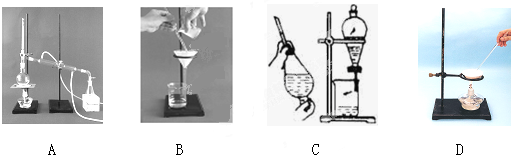
 已知Fe(OH)2是白色难溶于水的物质,很容易被空气中的氧气氧化为Fe(OH)3.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其它试剂自选.请填写下列空白:
已知Fe(OH)2是白色难溶于水的物质,很容易被空气中的氧气氧化为Fe(OH)3.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化.实验时必须使用铁屑和6mol/L的硫酸,其它试剂自选.请填写下列空白: