
题目列表(包括答案和解析)

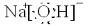
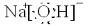
| ||
| ||
已知:⑴Al(OH)3的电离方程式为:AlO2-+H++H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-;⑵无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-;⑶PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb。下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是
Al3++3OH-;⑵无水AlCl3晶体的沸点为182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-;⑶PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb。下列关于Al(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是
A.均为强电解质 B.均为弱电解质
C.均为离子化合物 D.均为共价化合物
欲使Al(OH)3全部转化为Al3+,最好加入下列试剂中的( )
欲使Al(OH)3全部转化为AlO2-,最好加入下列试剂中的( )
A.NaOH B.NH3.H2O C.HCl溶液 D.CO2和水
欲使Al(OH)3全部转化为AlO2-,最好加入下列试剂中的( )
A.NaOH B.NH3.H2O C.HCl溶液 D.CO2和水


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com