
题目列表(包括答案和解析)

二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图.
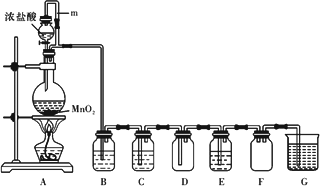
(1)圆底烧瓶中发生反应的化学方程式为________.
(2)A中m管的作用是________.
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是________.
(4)E中若装有FeCl2溶液,反应的离子方程式为________;E中若装有淀粉碘化钾溶液,能观察到的实验现象是________.
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气.针对上述现象,长郡中学高二化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是________;
实验c的目的是________.
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成.由此得出影响氯气生成的原因是________.
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。

(1)写出圆底烧瓶中反应的化学方程式 。
(2)A中m管的作用是 ;装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 ,C中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。

(1)写出圆底烧瓶中反应的化学方程式 。
(2)A中m管的作用是 ;装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 ,C中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
(10分)二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,下图是制取并探究Cl2化学性质的装置图。
(1)圆底烧瓶中发生反应的化学方程式为 。
(2)A 中m 管的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,长郡中学高二化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体,加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2 中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;
实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
一、选择题(本题共10分),每小题2分,选对得2分,选错得0分。
1―5DDCDB
二、选择题(本题共36分),每小题3分,选对得3分,选错得0分
6―10CDCAB 11―15BCDDC 16―17BD
三、选择题(本题共20分),每小题4分,若正确答案啼包括一个选项,选对得4分,错选若多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。
18.AC 19.B 20.BD 21.AC 22.C
四、(本题共24分)
(1)3s23p4,14。(1分×2)
(2)2Al+2OH-+2H2O→2AlO2-+3H2↑,小于。(1分×2)
|