
题目列表(包括答案和解析)
(5分),(1)以甲烷为燃料制作新型燃料电池,电解质为氢氧化钾溶液。电池负反应式为 ;放电时钾离子移向电池的 (填“正”或“负”) 极
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,
则H2CO3 HCO3-+H+的平衡常数K1= (已知10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中
c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
(5分),(1)以甲烷为燃料制作新型燃料电池,电解质为氢氧化钾溶液。电池负反应式为 ;放电时钾离子移向电池的 (填“正”或“负”) 极
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,
则H2CO3  HCO3-+H+的平衡常数K1= (已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= (已知10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中
c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
(10分);四只试剂瓶中分别盛装有NaNO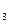 溶液、Na
溶液、Na CO
CO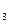 溶液、Na
溶液、Na SO
SO 溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
溶液和NaCl溶液,就如何检验这四种溶液分别回答下列各题:
在 四支试管中分别取四种溶液各1mL,做下列实验。
四支试管中分别取四种溶液各1mL,做下列实验。
(1)在四支试管中分别滴入 (填试剂名称),检验出的物质是 ,发生反应的化学方程式是
(2)在剩余三支试管中分别滴入 (填试剂的化学式),检验出的物质是 ,发生反应的离子方程式是
(3)在剩余两支试管中分别滴入 (填试剂的化学式),检验出的物质是
(5分),(1)以甲烷为燃料制作新型燃料电池,电解质为氢氧化钾溶液。电池负反应式为 ;放电时钾离子移向电池的 (填“正”或“负”) 极
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,
则H2CO3  HCO3-+H+的平衡常数K1=
(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
(已知10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中
c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是
(用离子方程式和必要的文字说明)。
 HCO3-+H+的平衡常数K1= (已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1= (已知10-5.60=2.5×10-6)湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com