
题目列表(包括答案和解析)
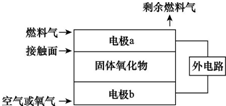 固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过.其工作原理如图所示.下列关于固体燃料电池的有关说法正确的是( )
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质,O2-可以在其内部自由通过.其工作原理如图所示.下列关于固体燃料电池的有关说法正确的是( )固体氧化物燃料电池(SOFC)以固体氧化物(能传导O2-)作为电解质,其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是

A.电极b为电池负极,电极反应式为O2+4e-=2O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,接触面上发生的反应为:H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,接触面上发生的反应为:C2H4+6O2--12e-=2CO2+2H2O
固体氧化物燃料电池(SOFC)以固体氧化物(O2-可以自由通过)作为电解质。其工作原理如图所示。下列关于固体燃料电池的有关说法正确的是
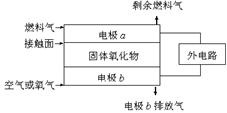
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为:H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
Ⅰ. 固体氧化物燃料电池(SOFC)以固体氧化物作为
电解质介质,其工作原理如图所示。
(1)电极b的电极反应式是
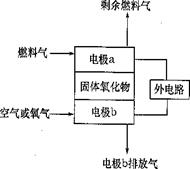 (2)假设外电路是电解硫酸铜溶液的装置。
(2)假设外电路是电解硫酸铜溶液的装置。
若以C2H4为燃料气,工作一段时间后
燃料电池中消耗了标准状况下的2.24LC2H4,
则外电路阴极区的产物及其物质的量分别
是 。
Ⅱ.下列试剂均可用于除去NaCl溶液中混有
的少量Na2S。
A. CaCl2 B.AgCl C.HCl
(1)最好的试剂是 (填写序号字母)。
写出加人该试剂时反应的离子方程式 。
(2)选用另外两种试剂实验时存在缺陷,简叙其主要缺陷:
Ⅰ. 固体氧化物燃料电池(SOFC)以固体氧化物作为
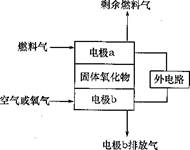 电解质介质,其工作原理如图所示。
电解质介质,其工作原理如图所示。
(1)电极b的电极反应式是
(2)假设外电路是电解硫酸铜溶液的装置。
若以C2H4为燃料气,工作一段时间后
燃料电池中消耗了标准状况下的2.24LC2H4,
则外电路阴极区的产物及其物质的量分别
是 。
Ⅱ.下列试剂均可用于除去NaCl溶液中混有
的少量Na2S。
A. CaCl2 B.AgCl C.HCl
(1)最好的试剂是 (填写序号字母)。
写出加人该试剂时反应的离子方程式 。
(2)选用另外两种试剂实验时存在缺陷,简叙其主要缺陷:
一、选择题:(本题包括15个小题,每小题3分,总共45分,每小题只有一个选项符合题意,请将符合题意的选项填在答题卷的相应位置。)
题号
1
2
3
4
5
6
7
8
答案
D
C
D
D
B
B
D
B
题号
9
10
11
12
13
14
15
答案
C
A
C
D
D
D
A
二、非选择题(本题包括6小题,共55分)
16.(10分)(1)确保氢氧化钠过量 (2分)
(2)红色沉淀可能是铜或铜与氧化亚铜的混合物(或红色固体中可能含有铜);方案3 (4分)
(3)②③⑤ (2分)
(4)在空气中充分灼烧该红色固体至全部转化成氧化铜,加入足量稀硫酸溶解,蒸发、结晶、过滤、洗涤,用滤纸吸干或通入惰气带走水分。 (2分)
17.(7分)(1)不能确定 (1分) : Ba2+、Mg2+ (1分)
(2)
阴离子符号
物质的量浓度(mol?L―1)
SO42-
0.1
CO32-
0.2
(2分)
(3)存在: (1分)
溶液中肯定存在离子是NH4+、CO32-和SO42-。经计算,NH4+的物质量为0.05mol,CO32-、SO42-的物质的量分别为0.02mol和0.01mol,根据电荷守恒,得K+一定存在(2分)
18.(10分)Fe3++H2S = S↓+2Fe2++2H+,(2分) Na2S+2H2O S↓+H2↑+2NaOH (2分)
S↓+H2↑+2NaOH (2分)
或S2-+2H2O S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2; (2分)
S↓+H2↑+2OH-,产物NaOH可循环使用,也可得副产品H2; (2分)
(2)阳离子(Na+),钛(或石墨); (2分) (3)4, 正四面体。 (2分)
19.(8分)(1)铝热 (置换)反应(2分) (2)4Fe2++8NH3.H2O+O2+2H2O=4Fe(OH)3↓+8NH4+(2分)或分两步写出亦可:①Fe2++2NH3.H2O=Fe(OH)2↓+2NH4+ ②4Fe(OH)2+O2+2H2O=4Fe(OH)3↓ (3)Al3+和Na+ (2分) (4)H2SO4(或HNO3) (2分)
20.(12分)
21.(8分)(1) 3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O (2分)
(2)16 g (2分) (没单位扣1分) (3)0.1 mol (2分)(没单位扣1分)
(4)0.05<n<0.15(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com