
题目列表(包括答案和解析)
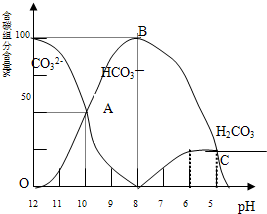 常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示:回答下列问题:
常温下在20mL 0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示:回答下列问题: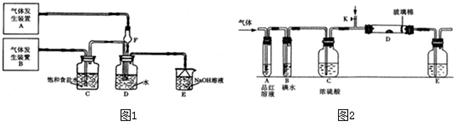
(11分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
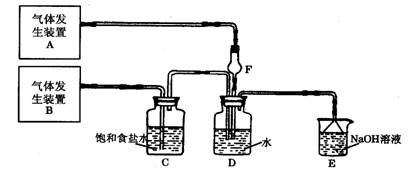
(1)气体发生装置A产生的气体是 ;
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
I :若Cl2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入 (选填一个序号)试剂,实验现象是: ;
II : 若SO2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,实验现象是: ;
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
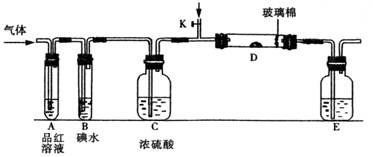
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0mol/L碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为 。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 .
(11分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
(1)气体发生装置A产生的气体是 ;
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
I :若Cl2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入 (选填一个序号)试剂,实验现象是: ;
II : 若SO2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,实验现象是: ;
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0mol/L碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为 。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 .
(11分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。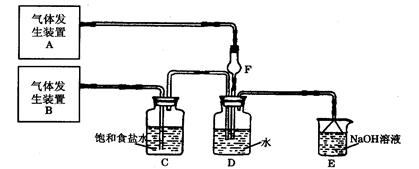
(1)气体发生装置A产生的气体是  ;
;
(2)为验证通入D装置中的气体是Cl2过量还是SO2过量,某小组同学准备了以下试剂:
① 氯化铁溶液 ② 氯化亚铁溶液 ③ 硫氰化钾溶液
④ 苯酚溶液 ⑤ 品红溶液 ⑥ 酸性高锰酸钾溶液
I :若Cl2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,再加入 (选填一个序号)试剂,实验现象是: ;
II : 若SO2过量:取适量D中溶液滴加至盛有 (选填一个序号)试剂的试管内,实验现象是: ;
(3)另一小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
②若装置B中装有5.0 mL 1.0mol/L碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为 。
(4)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 .
一、选择题(每小题2.5分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
D
B
D
C
D
B
A
B
C
题号
11
12
13
14
15
16
17
18
19
20
答案
C
C
D
C
A
D
C
B
C
A
二、填空题(每空2分,共28分)
21、(1)AlO2-;(2)Zn+2OH-=ZnO22-+H2↑ (3)①③④
22、(1)Fe3++3H2O Fe(OH)3+3H+ CaCO3+2H+===Ca2++CO2↑+H2O
Fe(OH)3+3H+ CaCO3+2H+===Ca2++CO2↑+H2O
(2)C
(3)HI是强电解质,使胶体聚沉;2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O
(4)①Fe(OH)3, 0.06mol;②0<X≤0.6
23.(1)P,第四周期第ⅥA族;
(2)SiO2+2OH-===SiO32-+H2O;
(3)2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑
三、实验题(每空2分,共20分)
24.(1)2、5、1、2、5、3 (2)0.2000;(3)ACD
25.(1)Cu2O或Fe2O3和Cu2O的混合物;
(2)取少许红色粉末溶于足量稀硫酸中,充分溶解后滴加KSCN溶液,再滴加双氧水;
有红色固体生成,加KSCN溶液不显红色,再加双氧水后显红色。
(3)①双氧水、碱式碳酸铜;②Fe(OH)3;③蒸发、浓缩、冷却、结晶。
四、计算题(10分)
26.(1)NH4+、Al3+、SO42-( (3分)
(2)NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O] (4分)
 (3)
(3)
(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com