
题目列表(包括答案和解析)
|
(原创)下列溶液说法正确的是 | |
| [ ] | |
A. |
常温时,浓度均为0.01 mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO |
B. |
下图表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
|
C. |
1.0×10-3 mol/L盐酸的pH=3.0,1.0*10-8 mol/L盐酸的pH=8.0 |
D. |
分别将等体积的等pH的醋酸和盐酸加水稀释100倍,所得溶液的pH:③>④ |
常温下在20 mL 0.1 mol/L Na2CO3溶液中逐渐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示,下列说法不正确的是
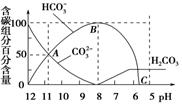
A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-)
B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.常温下CO2饱和溶液的pH约为5.6
D.0.05 mol/L NaHCO3溶液的pH=8

| A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-) |
| B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.0.05 mol/L NaHCO3溶液的pH=8 |
常温下在20 mL 0.1 mol/L Na2CO3溶液中逐渐滴加入0.1 mol/L HCl溶液40 mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示,下列说法不正确的是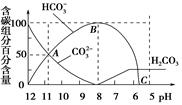
| A.0.1 mol/L Na2CO3溶液中c(OH-)-c(H+)=2c(H2CO3)+c(HCO3-) |
| B.在A点c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C.常温下CO2饱和溶液的pH约为5.6 |
| D.0.05 mol/L NaHCO3溶液的pH=8 |
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 __________________
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 ________ (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 __ (填“甲”或“乙”)判断正确。试剂X是 ___________
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH _______ (填“高于”、“低于”或“等于”)8.3,则 __________ (填“甲”或“乙”)判断正确。
(3)常温下,在测得pH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的具体关系是 ________
(4)25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是_________________
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者小于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com