
题目列表(包括答案和解析)
| NH | + 4 |
| C2O | 2- 4 |

KMnO4是一种重要的氧化剂。
(1)①在酸性条件下KMnO4的氧化性会增强。用来酸化KMnO4溶液的最佳试剂是 。
a.硝酸 b.硫酸 c.盐酸
②将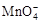 氧化C2O42−的离子方程式补充完整:
氧化C2O42−的离子方程式补充完整:
□MnO4− +□C2O42−+□ ==□Mn2+ +□CO2↑+□ 。
(2)某同学为了探究KMnO4溶液和Na2C2O4(草酸钠)溶液的反应过程,进行如下实验:
①配制100 mL 0.0400 mol·L-1的Na2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是 。
②将KMnO4溶液逐滴滴入一定体积的酸性Na2C2O4溶液中(温度相同,并不断振荡),记录的现象如下:
|
滴入KMnO4溶液的次序 |
KMnO4溶液紫色褪去所需的时间 |
|
先滴入第1滴 |
60 s |
|
褪色后,再滴入第2滴 |
15 s |
|
褪色后,再滴入第3滴 |
3 s |
|
褪色后,再滴入第4滴 |
1 s |
请分析KMnO4溶液褪色时间变化的可能原因 。
③用配制好的0.040 0 mol·L-1的Na2C2O4溶液来标定某KMnO4溶液的浓度。每次准确量取25.00 mLNa2C2O4溶液,然后用酸化后的KMnO4溶液滴定。滴定三次分别消耗的KMnO4溶液的体积是20.00 mL、19.80 mL、20.20 mL,则KMnO4溶液的浓度为 。
 、Na+、H+,阴离子:Cl-、OH-、
、Na+、H+,阴离子:Cl-、OH-、 ),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:
),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:
| A.熔融的NaHSO4中阴阳离子的个数比为2:1 |
| B.1L1mol?L-1的Na2C2O4溶液中阴离子总数大于NA |
| C.分子数为NA的CO、C2H4混合气体质量为28g,体积为22.4L |
| D.12g金刚石晶体中含有的碳碳键数目为NA |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com