
题目列表(包括答案和解析)
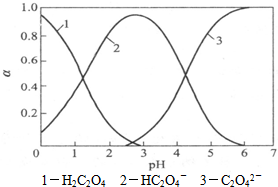 草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
草酸(H2C2O4)是一种二元弱酸,受热能分解,它在水溶液中存在形式的分布与pH关系如图所示:
| ||
| ||
| 酸 | 铁锈[Fe(OH)3]溶解量/g | 水垢(CaCO3)溶解量/g |
| 盐酸 | 0.7911 | 全溶 |
| 磷酸 | 0.1586 | 微溶 |
| 草酸 | 0.7399 | 0.0036 |
| 醋酸 | 0.1788 | 0.1655 |
常温下,可发生反应:A(g)+B(g)?C(g)+xD(g) 若将2mol A和2mol B 混合充入体积可变的密闭容器中,在不同压强下达到平衡时,C的浓度如下:
|
硅单质及其化合物应用范围很广,请回答下列问题:
(1) 制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
|
|
|
![]()
|
|
|
|
|
|
 |
①写出由纯SiHCl3制备高纯硅的化学反应方程式 。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式 ;H2还原SiHCl3过程中若混02,可能引起的后果是 。
(2)下列有关说法正确的是 (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.普通玻璃的成分有纯碱、石灰石和石英砂,其熔点很高
D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)取少量硅酸钠溶液于试管中,逐滴加入盐酸溶液,振荡,则反应的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com