
题目列表(包括答案和解析)
(12分)、红钒钠(重铬酸钠:Na2Cr2O7?2H2O,橙红色晶体)是重要的化工原料。工业上用铬铁矿(FeO?Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠。
(1)步骤I的反应有:4 FeO?Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1mol Na2CrO4转移的电子数为 mol;原料中加入CaCO3的作用是
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度![]()
C.分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤III过滤前要用稀H2SO4将浸取液的pH调至7~8,
并煮沸除去铝和硅的化合物,其离子方程式为:
(3)步骤IV反应为:2CrO42-+2H+![]() Cr2O72-+H2O,平衡常数表达式为:K=
Cr2O72-+H2O,平衡常数表达式为:K=
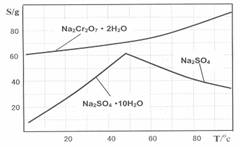 右图是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线:
右图是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线:
(4)据此,步骤V操作的方法是:将IV所得溶液 (填操作),趁热过滤得到的晶体是 (填化学式);然后将所得溶液 (填操作),得到的晶体是 。
红钒钠(重铬酸钠:Na2Cr2O7?2H2O,橙红色晶体)是重要的化工原料。工业铬铁矿(FeO?Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠。
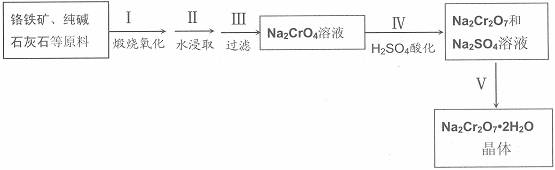 (1)步骤I的反应有:4 FeO?Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1mol Na2CrO4转移的电子数为 mol;原料中加入CaCO3的作用是
(1)步骤I的反应有:4 FeO?Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1mol Na2CrO4转移的电子数为 mol;原料中加入CaCO3的作用是
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
C.分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤III过滤前要用稀H2SO4将浸取液的pH调至7~8,并煮沸除去铝和硅的化合物,其离子方程式为:
(3)步骤IV反应为:2CrO42-+2H+= Cr2O72-+H2O,平衡常数表达式为:K=
下图是Na2Cr2O7?2H2O和Na2SO4的溶解度曲线:
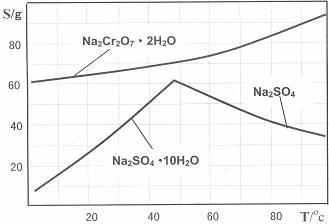
(4)据此,步骤V操作的方法是:将IV所得溶液 (填操作),趁热过滤得到的晶体是 (填化学式);然后将所得溶液 (填操作),得到的晶体是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com