
题目列表(包括答案和解析)
| 催化剂 |
| △ |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
| 1 | 2 |

 O2(g)?SO3(g);△H=-98kJ?mol-1.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=______.
O2(g)?SO3(g);△H=-98kJ?mol-1.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=______.



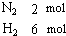
 2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:
2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题: 2SO3(g).根据下列要求填写空白:
2SO3(g).根据下列要求填写空白:

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com