
题目列表(包括答案和解析)
(10分)实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为 。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯 。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为 g,要完成本实验该同学应称出 g NaOH。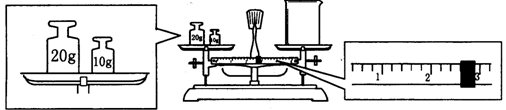
(3)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是__________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞摇匀,静置后,液面低于刻度线,再加水至刻度线。
①石蕊试纸(检验气): 。②容量瓶: 。③酸式滴定管: 。④集气瓶(收集氯化氢): 。?
(2)请按要求填空:?
①用已准确称量的1.06 g Na2CO3固体配制0.100 mol·L-1Na2CO3溶液100 mL,所需要的仪器为 。②除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为 、蒸发、结晶、 。?
③除去KCl溶液中的![]() ,依次加入的溶液为(填溶质的化学式): 。测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1 g为止 ⑦根据实验数据计算硫酸铜晶体里结晶水的含量。
,依次加入的溶液为(填溶质的化学式): 。测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1 g为止 ⑦根据实验数据计算硫酸铜晶体里结晶水的含量。
(3)请回答下列问题:?
①现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是 。?
②该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么??
答: 。?
③实验步骤⑥的目的是 。?
④若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有 (填入选项的编号)。
A.被测样品中含有加热不挥发的杂质? B.被测样品中含有加热易挥发的杂质?
C.实验前被测样品已有部分失水? D.加热前所用的坩埚未完全干燥?
请完成下列各题:
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是__________________________________________。
(2)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答:_________________________________________________________________。
(3)实验步骤⑥的目的是____________________________________________________。
(4)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号) ____________。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
(10分)实验室欲用NaOH固体配制1.0mol/L的NaOH溶液240mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为 。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯 。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图. 烧杯的实际质量为 g,要完成本实验该同学应称出 g NaOH。
(3)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是__________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥ 定容后塞上瓶塞摇匀,静置后,液面低于刻度线,再加水至刻度线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com