
题目列表(包括答案和解析)
(1)若保持压强、温度不变,向该容器里再通入1 mol SO2和0.5 mol O2,则平衡时SO3的含量______A%(填“大于”“等于”或“小于”,下同)。
(2)若保持压强、温度不变,向该容器里通入1 mol N2,则平衡时SO3的含量__________A%。
(3)若保持体积、温度不变,向该容器中通入1 mol N2,则平衡时SO3的含量__________A%。
(4)若保持体积不变,温度升高100 ℃,此温度下容器内的压强________p,平衡向_________方向移动。
(14分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ?mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ?mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol?L-1?min-1,则υ(O2)= mol?L-1?min-1、υ(SO3)= mol?L-1?min-1;
(5)已知单质硫的燃烧热为296 KJ?mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(1)将容器的体积缩小一半,其正反应速率__________,逆反应速率__________。(填“增大”“减小”或“不变”,以下同)。
(2)保持体积不变,充入N2使体系压强增大,其逆反应速率_________。
(3)保持压强不变,充入N2使容器的体积增大,其正反应速率_________。

请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;
(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=_______mol·L-1·min-1、v(SO3)=_______mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH_______(要求计算过程)。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
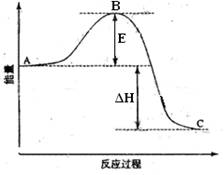
![]() (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
![]() (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1;
![]() (3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
![]() (4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
![]() (5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com