光气(COCl
2)在塑料、制革、制药等工业中有许多用途,工业上采用CO与Cl
2在活性炭催化下合成.
(1)实验室中常用来制备氯气的化学方程式为
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
;
(2)工业上利用天然气(主要成分为CH
4)与CO
2进行高温重整制备CO,已知CH
4、H
2和CO的燃烧热(△H)分别为-890.3kJ?mol
-1、-285.8kJ?mol
-1、-283.0kJ?mol
-1,则生成1m
3(标准状况)CO所需热量为
5.52×103KJ
5.52×103KJ
;
(3)实验室中可用氯仿(CHCl
3)与双氧水直接反应制备光气,其反应的化学方程式为
CHCl3+H2O2=HCl+H2O+COCl2
CHCl3+H2O2=HCl+H2O+COCl2
;
(4)COCl
2的分解反应为COCl
2(g)=Cl
2(g)+CO(g)△H=+108kJ?mol
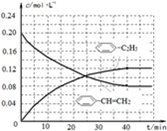
-1.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的浓度变化曲线未示出):

①计算反应在第8min时的平衡常数K=
0.234mol?L-1
0.234mol?L-1
;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)
<
<
T(8)(填“>”、“<”或“=”)
③若12min时反应于T(8)下重新达到平衡,则此时c(COCl
2)=
0.031
0.031
mol?L
-1④比较产物CO在2~3min、5~6min、12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小
v(5~6)>v(2~3)=v(12~13)
v(5~6)>v(2~3)=v(12~13)
;
⑤比较反应物COCl
2在5~6min、15~16min时平均反应速率的大小:v(5~6)
>
>
v(15~16)(填“>”、“<”或“=”),原因是
在相同温度时,该反应的反应物的浓度越高,反应速率越大
在相同温度时,该反应的反应物的浓度越高,反应速率越大
.

 在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡.
在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡. 二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
二甲醚(CH3OCH3)是一种高效、清洁,具有优良环保性能的新型燃料.工业上制备二甲醚时在催化反应室中(压强2.0~10.0MPa,温度230~280℃)进行的反应为:
 -C2H5)可生产塑料单体苯乙烯(
-C2H5)可生产塑料单体苯乙烯( -CH=CH2),其原理反应是:
-CH=CH2),其原理反应是: -C2H5(g)
-C2H5(g) 
 -CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol
-CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol  -C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表: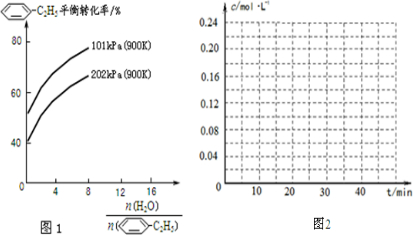
 -C2H5)/mol
-C2H5)/mol -CH=CH2)/mol
-CH=CH2)/mol -C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将
-C2H5(g)的平衡转化率与水蒸气的用量、体系总压强的关系如图1所示.当其它条件不变时,水蒸气的用量越大,平衡转化率将 -CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,请在图2中画出并标明该条件下  -C2H5(g)和
-C2H5(g)和 -CH=CH2(g)的浓度c随时间t变化的曲线
-CH=CH2(g)的浓度c随时间t变化的曲线