
题目列表(包括答案和解析)
(12分)请按要求填空:
(1)下列叙述完全正确的是_____________(填序号)
A、测溶液pH的方法是:取一小片广泛pH试纸置于玻璃片或表面皿上,再用干燥、洁净的玻璃棒蘸取溶液,点在pH试纸中部,然后在30S内跟标准比色卡比较
B、在测定硫酸铜晶体结晶水含量的实验中,下列操作都会导致测定结果偏高:①加热前称量容器时,容器未完全干燥 ②加热过程中有少量晶体溅出 ③加热后容器未放入干燥器中冷却
C、配制0.1 mol·L-1的NaCl溶液250 mL,烧杯、玻璃棒、250 mL的容量瓶、胶头滴管等玻璃仪器必须用到。
D、用50 mL酸式滴定管量取25.00 mL稀盐酸的操作可以是:先将稀盐酸注入酸式滴定管,调节其凹液面正好与25 mL刻度相切,然后将溶液全部放入50 mL锥形瓶中。
E、硝酸钾溶解度测定的实验中,温度计的水银球应处于烧杯中的水浴液面以下;分馏石油时,温度计的水银球应处于蒸馏烧瓶的支管口处。
F、仪器洗涤中常采用下列方法:①用酒精清洗制取酚醛树脂用过的大试管 ②用氨水清洗做过银镜反应的试管③用浓盐酸稍加热清洗用高锰酸钾制氧气后的试管
(2)实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D、E是常见的一些保存药品的的试剂瓶。请把下列常见的试剂的序号填写在各试剂瓶下方的括号里: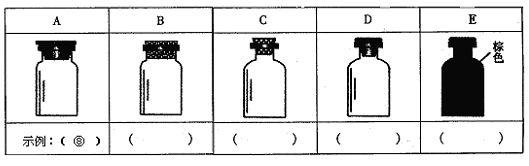
①浓硫酸②碳酸钾溶液③碱石灰④四氯化碳⑤氯水⑥浓硝酸⑦硝酸银溶液⑧金属钠
(12分)请按要求填空:
(1)下列叙述完全正确的是_____________(填序号)
A、测溶液pH的方法是:取一小片广泛pH试纸置于玻璃片或表面皿上,再用干燥、洁净的玻璃棒蘸取溶液,点在pH试纸中部,然后在30S内跟标准比色卡比较
B、在测定硫酸铜晶体结晶水含量的实验中,下列操作都会导致测定结果偏高:①加热前称量容器时,容器未完全干燥 ②加热过程中有少量晶体溅出 ③加热后容器未放入干燥器中冷却
C、配制0.1 mol·L-1的NaCl溶液250 mL,烧杯、玻璃棒、250 mL的容量瓶、胶头滴管等玻璃仪器必须用到。
D、用50 mL酸式滴定管量取25.00 mL稀盐酸的操作可以是:先将稀盐酸注入酸式滴定管,调节其凹液面正好与25 mL刻度相切,然后将溶液全部放入50 mL锥形瓶中。
E、硝酸钾溶解度测定的实验中,温度计的水银球应处于烧杯中的水浴液面以下;分馏石油时,温度计的水银球应处于蒸馏烧瓶的支管口处。
F、仪器洗涤中常采用下列方法:①用酒精清洗制取酚醛树脂用过的大试管 ②用氨水清洗做过银镜反应的试管 ③用浓盐酸稍加热清洗用高锰酸钾制氧气后的试管
(2)实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D、E是常见的一些保存药品的的试剂瓶。请把下列常见的试剂的序号填写在各试剂瓶下方的括号里:

①浓硫酸②碳酸钾溶液③碱石灰④四氯化碳⑤氯水⑥浓硝酸⑦硝酸银溶液⑧金属钠

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com