
题目列表(包括答案和解析)


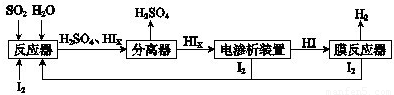
(14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: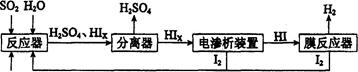
回答下列问题:
(1)在反应器中发生反应的化学方程式是______________。
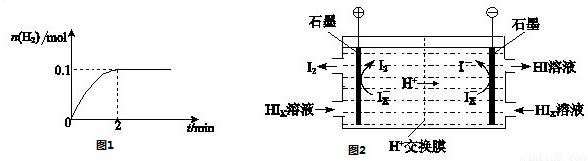
(2)在膜反应器中发生反应:2HI(g) H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示: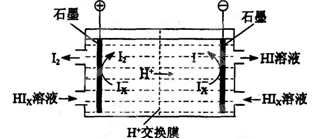
①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
(4)上述工艺流程中循环利用的物质是_________。

 H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:


| 1 |
| 64 |
| 1 |
| 64 |

一、选择题(共10分)
1、C 2、D 3、C 4、A 5、B
二、选择题(共45分)
6、C 7、C 8、B 9、B 10、C
11、D 12、C 13、B 14、A 15、C
16、D 17、B 18、D 19、C 20、C
三、填空题(共34分)
21、(2分) △H1<△H3<△H2
|