
题目列表(包括答案和解析)
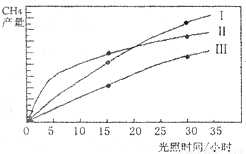
(10分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I ,II,III)作用下,CH4的产量随光照时间的变化如下图所示。
(1)在O〜30小时内,CH4的平均生成速率和
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应
CH4(g)+H2O(g)CO(g)+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
(3)该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH⑴的燃烧热分别为
和
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
(4)工业上常利用反应CO(g)+2H2(g) CH3OH (g), △H<0合成甲醇,在230°C〜270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
①2700C的实验结果所对应的曲线是_________(填字母);
②2300C时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是_________(填字母)。
A. 1 〜1.5 B. 2. 5〜3 C. 3. 5〜4. 5
(5)某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为_________。
(10分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I ,II,III)作用下,CH4的产量随光照时间的变化如下图所示。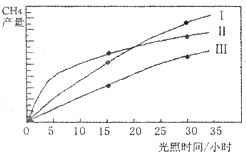
(1) 在O?30小时内,CH4的平均生成速率 和
和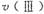 由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应
CH4(g)+H2O(g)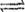 CO(g) +3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
CO(g) +3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
(3) 该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH⑴的燃烧热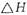 分别为
分别为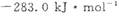 和
和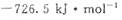 ,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
(4)工业上常利用反应CO(g)+2H2(g) 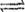 CH3OH (g), △H<0合成甲醇,在230°C?270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
CH3OH (g), △H<0合成甲醇,在230°C?270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。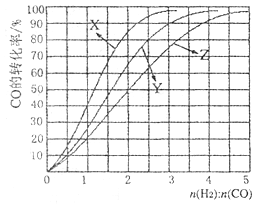
①2700C的实验结果所对应的曲线是_________ (填字母);
②2300C时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是_________ (填字母)。
A. 1 ?1.5 B. 2. 5?3 C. 3. 5?4. 5
(5) 某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为_________。
(10分)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I ,II,III)作用下,CH4的产量随光照时间的变化如下图所示。
(1)
在O〜30小时内,CH4的平均生成速率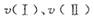 和
和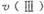 由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应
CH4(g)+H2O(g) CO(g)
+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
CO(g)
+3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
(3)
该反应产生的CO和H2可用来合成可再生能源甲醇,已知CO(g)、CH3OH⑴的燃烧热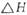 分别为
分别为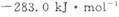 和
和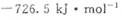 ,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
(4)工业上常利用反应CO(g)+2H2(g)
 CH3OH (g), △H<0合成甲醇,在230°C〜270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
CH3OH (g), △H<0合成甲醇,在230°C〜270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
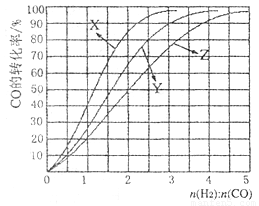
①2700C的实验结果所对应的曲线是_________ (填字母);
②2300C时,工业生产适宜釆用的合成气组成n(H2):n(CO)的比值范围是_________ (填字母)。
A. 1 〜1.5 B. 2. 5〜3 C. 3. 5〜4. 5
(5) 某同学以石墨为电极,以KOH溶液为电解质设计甲醇燃料电池,其负极的电极反应式为_________。

 和
和 由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。
由大到小的顺序为_________;反应开始后的15小时内,在第_________种催化剂的作用下,收集的CH4最多。 CO(g) +3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。
CO(g) +3H2(g) △H=+206kJ·mol-1。将等物质的量的CH4和H2O(g)充入1L恒容密闭容器,某温度下反应达到平衡,此时测得CO的物质的量为O.10 mol,CH4的平衡转化率为91 %,则此温度下该反应的平衡常数为_________ (计算结果取整数)。 分别为
分别为 和
和 ,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。
,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为_________。 CH3OH (g), △H<0合成甲醇,在230°C?270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
CH3OH (g), △H<0合成甲醇,在230°C?270°C最为有利。为研究合成气最合适的起始组成比n(H2):n(C0),分别在230°C、2500C和2700C进行实验,结果如图。
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1、-283.0kJ?mol-1和-726.5kJ?mol-1.请回答下列问题:| nA |
| tA |
| 2-a |
| 2 |
| 2-a |
| 2 |
第I卷共21小题,每小题6分,共126分。
一、选择题:本题共13小题,每小题6分,共78分
1―5CDACB 6―10ACDBD 11―13DCA
二、选择题:本题共8小题,每小题6分,共48分。全部选对的给6分,部分选对的给3分,有选错的给0分。
14.A 15.AD 16.BC 17.C 18.AD 19.B 20.C 21.B
第Ⅱ卷共17题,共174分
(一)必考题(8分,共129分)
22.(15分)
(1)0.552~0.554(结果在此范围内得3分)
(2)①刻度尺(2分)
②刻度尺 小球在木板上的落点的斜槽末端的水平距离s(2分)
刻度尺 斜槽末端到木板的竖直高度H(2分)
③.files/image110.gif) (2分)
(2分) .files/image112.gif) (2分)
(2分)
④AD(全部选对得2分,选对但不全得1分)
或者
①刻度尺 秒表(1分)
②刻度尺 小球在木板上的落点到斜槽末端的水平距离s(2分)
秒表 小球从斜槽末端下落到木板上的时间t(1分)
③.files/image110.gif) (2分)
(2分) .files/image115.gif) (2分)
(2分)
④AD(全部选对得2分,选对但不全得1分)
23.(15分)解:
(1)B球到达最低点时,系统减少的机械能
.files/image117.gif) (2分)
(2分)
因为.files/image119.gif) (2分)
(2分)
所以.files/image121.gif) (1分)
(1分)
(2)A球到达最低点时,由系统机械能守恒得:
.files/image123.gif) (3分)
(3分)
AB具有相同的角速度,转动半径.files/image125.gif)
所以.files/image127.gif) (2分)
(2分)
A、B下落的高度分别为
.files/image129.gif) ,(2分)
,(2分)
可得.files/image131.gif) (3分)
(3分)
24.(17分)解:
(1)设ab边刚进入磁场I区域时的速度为.files/image133.gif) ,由动能定理得:
,由动能定理得:
.files/image135.gif) (1分)
(1分)
.files/image137.gif)
.files/image139.gif) (1分)
(1分)
.files/image141.gif) (1分)
(1分)
ab间的电压.files/image143.gif) (2分)
(2分)
(2)线框ab边运动到NN′位置之前,只有ab边从PP′位置沿斜面下滑2L的过程产生感应电流,设线框ab边在II区域匀速运动的速度为.files/image145.gif) ,线圈中电流为I2,ab和cd两个边切割磁感线,总电动势
,线圈中电流为I2,ab和cd两个边切割磁感线,总电动势
.files/image147.gif) (2分)
(2分)
.files/image149.gif) (1分)
(1分)
ab和cd两个边受沿斜面向上的安培力,
.files/image151.gif) (2分)
(2分)
线框做匀速运动时,.files/image153.gif) (1分)
(1分)
.files/image155.gif)
根据能量转化与守恒定律
.files/image157.gif) (3分)
(3分)
.files/image159.gif) (3分)
(3分)
25.(14分)
(1)一定含NH4+、Al3+、Fe2+、SO42-、Cl-(各1分,错答正误抵消)
(2)一定不含有NO3-(1分);根据题意判断出溶液中一定含有Fe2+,而向溶液中加盐酸酸化后无明显现象,说明没有NO3-(2分)
(3)可能含有Na+(1分)焰色反应(2分)
(4)依据题意,进行定性、定性分析可知n(NH4+)=0.2mol、n(Al3+)=0.1mol、n(Fe2+)=0.2mol、
n(SO42-)=0.3mol,溶液中没有NO3-,根据电荷守恒必须存在Cl-(3分)
(其他合理答案参照给分)
26.(14分)
(1)60%(2分) 0.6mol/L(2分) -41kJ/mol(2分)
(2)0.6mol/L(1分),始起的浓度是相同的,属于等效平衡。(平衡浓度只与参加反应的物质的总浓度有关,而与过程(是一步还是分步完成)无关)或答依据化学平衡常数计算。(其他合理答案参照给分)(1分)
(3)C D(2分)(多选或选错都不得分)
|