
题目列表(包括答案和解析)
(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现沉淀逐渐转变为红褐色,并产生无色气体。用离子方程式表示产生上述现象的原因 。
(2)在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是
A.磷 B.硫 C.镁 D.铜
(3)在Fe(OH)3胶体中,逐滴加入HI稀溶液。出现的现象是:先产生红褐色沉淀,其原因是 ,随后沉淀溶解,其离子方程式是 。
(4)向物质的量之和为0.1mol的FeCl3和AlCl3混合溶液中加入90mL4mol/L的NaOH溶液,使其充分反应。假设原溶液中Al3+的物质的量与Al3+和Fe3+的总物质的量之比为X。
①当X=0.4时,溶液中产生的沉淀是 ,其物质的量为 。
②当沉淀只有Fe(OH)3时,X的取值范围为 。
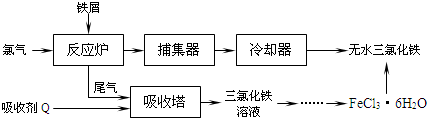
| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
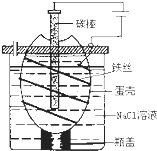 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
| ||
| ||
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3; 乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探
究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 。
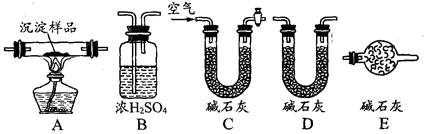
(2)若丙同学的观点正确,可利用下列装置通过实验测定其组成。
①实验装置的连接顺序为_________________________________。
②装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
③若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________。
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
| A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁 |
| B.用酸式滴定管量取18.80mL的碳酸钠溶液 |
| C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低 |
| D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体 |
第Ⅰ卷(选择题21题,每题6分,共126分)
一、选择题(本题包括13小题。每小题只有一个选项最符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
C
A
D
C
B
B
D
C
D
题号
10
11
12
13
14
15
16
17
答案
C
B
D
A
B
B
C
D
二、选择题(本题共4小题。在每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但选不全的得3分,有选错的得0分)
题号
18
19
20
21
答案
ABC
BD
CD
BC
第Ⅱ卷(非选择题10题,共174分)
 22. (18分)
22. (18分)
Ⅰ.(8分) 0.21 (4分) 0.60-0.61 (4分)
Ⅱ.(10分)
电路图如甲所示,………………………(6分)
(元件的代号未标明或标错的,酌情扣分)
实物图连线如乙所示……………………(4分)
23.(14分)解:(1)传输轮对铁板的摩擦力大小为:
 ……(4分)
……(4分)
(2)铁板在传输轮下加速时,由牛顿第二定律可得,加速度大小
 …………………………(3分)
…………………………(3分)
若铁板在传输轮下一直处于加速状态,并设离开传输轮时的速度大小为 ,由运动学公式有:
,由运动学公式有:
 ……………………………………………………………(2分)
……………………………………………………………(2分)
解得: ………………(1分)
………………(1分)
传输轮边缘线速度大小 ………(2分)
………(2分)
由于 ,所以铁板一直处于加速状态,铁板离开传输轮时的速度大小为
,所以铁板一直处于加速状态,铁板离开传输轮时的速度大小为 。(2分)(用时间、位移判断运动情况同样给分,未作判断扣4分)
。(2分)(用时间、位移判断运动情况同样给分,未作判断扣4分)

24.(18分)解:由题意,画粒子的运动轨迹如图所示,图中D为轨迹
与OP的交点。
(1)粒子从P运动到D需时
 …………………………………(3分)
…………………………………(3分)
粒子从D运动到O需时
 …………………………………………………(3分)
…………………………………………………(3分)
所以粒子从P点运动点O点的时间
 …………………………………………………………(2分)
…………………………………………………………(2分)
(2)设粒子的入射速度大小为 ,则粒子在甲、乙两区域内运动时的轨道半径分别为
,则粒子在甲、乙两区域内运动时的轨道半径分别为
 ……………………………………………………………………(2分)
……………………………………………………………………(2分)
 …………………………………………………………………(2分)
…………………………………………………………………(2分)
则有 ---------① …………………………………………………(1分)
---------① …………………………………………………(1分)
由几何关系,有:(R1 + R2)+ (R1 + R2)cos600 = L cos300 --------②……(3分)
由①②两式可解得, ………………………………………(2分)
………………………………………(2分)
25.(22分)(1) 如图,设绝缘轨道半径为R,A到板N的距离为d,AB的竖直距离为y,C到板N的距离为x;到达最低点D的速度为vD,到A点时的速度为vA ,到达孔B时的速度为vB 。
 球在离开A经B到C的过程中,竖直方向只受重力作用,故从A到B和从B到C的时间相等,并设从A到B的时间为t。(2分)
球在离开A经B到C的过程中,竖直方向只受重力作用,故从A到B和从B到C的时间相等,并设从A到B的时间为t。(2分)
则有: -----------------①…………(1分)
-----------------①…………(1分)
 -----------------②…………(1分)
-----------------②…………(1分)
由①②得, -----------③…………(1分)
-----------③…………(1分)
由题意, --------- ④………………(1分)
--------- ④………………(1分)
在水平方向上,有 ---------------⑤……(2分)
---------------⑤……(2分)
在竖直方向上,有 ------------⑥ ………(2分)
------------⑥ ………(2分)
则③④⑤⑥四式,解得板间场强的大小 ……(2分)
……(2分)
(2)从A到B的过程中,有  --------⑦…(2分)
--------⑦…(2分)
由题意 ------------------⑧
------------------⑧
由④⑦⑧三式可解得 ------------------⑨
------------------⑨
从D到A,根据机械能守恒,有
 -----------------⑩…(3分)
-----------------⑩…(3分)
 由⑨⑩ 三式可解得,轨道对小球的支持力
由⑨⑩ 三式可解得,轨道对小球的支持力  ………………(2分)
………………(2分)
由牛顿第三定律,得小球在最低点D对轨道的压力大小为 ……(1分)
……(1分)
(其它解法相应给分)
26.(12分)
(1) Cl2, SO2, Na2SO3 (各1分)
 (2)①2Cl― +
2H2O Cl2↑+ H2↑+ 2OH― (2分)
(2)①2Cl― +
2H2O Cl2↑+ H2↑+ 2OH― (2分)
②BaSO3 +2H+ + SO42― = BaSO4↓+ SO2↑+ H2O (2分)
(3)①变红色(1分); Cl2+SO2+2H2O=H2SO4+2 H Cl (2分)
②先变红后褪色(或褪色)(1分);变红是因为溶液呈酸性,褪色是因为氯气过量生成次氯酸使溶液褪色。 (1分)
27.(14分)
(1)减小(1分); 减小 (1分)
(2)<(1分);当0.5mol N2和1.5mol H2完全反应时,才能放出46.2kJ的热量,但此反应不
能进行到底,所以放热小于46.2kJ。(2分)(其它合理答案也给分)
(3)D(2分)
(4)33.3%(2分);100/27 L2?mol-2(单位写与不写都可以)(2分);减小(1分)
(5)A、D(2分)
28.(共17分)
Ⅰ.(7分)
(1)④ 过滤 (1分) 烘干 (1分)
⑤ 取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净 (2分)
(2)① 相同时间内产生气体的体积(或产生相同体积气体所需要的时间) (2分)
② CuO的质量在反应前后是否发生改变(1分)
Ⅱ.(10分)
(3)A(1分) B C(1分)
赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2(或避免Fe2+被氧化)(2分)
(4)① 1 5 8 5 1 4 (2分)
② 酸式 (1分); 当溶液变成紫红色且30s内不褪色 (1分)
③ 80% (2分)
29.(15分)
(1)羧基、羟基 (2分)
(2)② (1分)
(3) (2分)
(2分)
 (2分)
(2分)
(4)  (2分)
(2分)
或
5mol (2分)
(5)2种 (2分)  或
或  (2分)
(2分)
30.(28分)
 Ⅰ.(共18分,每空2分)
Ⅰ.(共18分,每空2分)
(1)光质、植物的部位、植物种类(写不全只得1分)
1和2或4和5(写一组只得1分)
(2)光合 暗反应 C3的还原
叶绿体、线粒体、细胞质基质(写不全只得1分)
(3)(2分)如图.
的点要对准。
Ⅱ.(共10分,每空2分)第一步:取三个玻璃缸,标号A、
B、C,各放入20只蝌蚪
第二步:A中加入适量的甲状腺激素,B中加等量的甲状腺抑制剂,C中不加
(或加等量的清水)
预测结果: B缸(加有甲状腺抑制剂) A缸(加有甲状腺激素)
排除因实验材料的差异造成对实验结果的影响
(只做2组不给分)
31.(共16分)(1)(每空2分)4 紫茎抗病:紫茎感病=1:1(未写出表现型只得1分)
3/4 配子
(2)①AAbb (1分) 全是紫茎感病(1分)
②AABb (1分) 紫茎抗病
F1 AABb
↓×
F2 AABB AABb AAbb
紫茎抗病 紫茎抗病 紫茎感病
1 : 2 : 1
(图解共4分,其中F2代基因型1分,比例1分、表现型1分,符号正确规范1分)
③乙(1分)
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com