
题目列表(包括答案和解析)
实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为: 2NH3+3CuO![]()
![]() N2+3Cu+3H2O
N2+3Cu+3H2O
试回答:(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)]时,请用下列仪器设计一个简单的实验方案。

①仪器连接的顺序(用字母编号表示,仪器可重复使用) ;d中浓硫酸的作用是 , ;实验完毕时观察到a中的现象是 ;
②列出计算Cu的相对原子质量的表达式 ;
③下列情况将使测定结果偏大的是 。(以下选择填空不限1个正确答案,均用字母编号填写)
(a)CuO未全部还原为Cu (b)CuO受潮 (c)CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有
(a)m(Cu)和m(CuO) (b)m(N2)和m(H2O) (c)m(Cu)和m(H2O) (d)m(NH3)和m(H2O)
(1)如果选用测定反应物CuO和生成物H2O的质量〔m (CuO)、m(H2O)〕时,请用下列仪器设计一个简单的实验方案:

①仪器连接的顺序(用字母编号表示,仪器可重复使用)__________;d中浓硫酸的作用是___________,___________;实验完毕时观察到a中的现象是____________。
②列出计算Cu的相对原子质量的表达式_____________。
③下列情况将使测定结果偏大的是_____________。(以下选择填空不限1个选项,均用字母编号填写)
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有__________________。
A.m(Cu)和m(CuO) B.m(N2)和m(H2O)
C.m(Cu)和m(H2O) D.m(NH3)和m(H2O)

 N2+3Cu+3H2O
N2+3Cu+3H2O

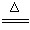


实验室用氨气还原氧化铜的方法测定铜的近似原子量,反应的化学方程式为:
2NH3+3CuO![]() N2+3Cu+3H2O
N2+3Cu+3H2O
请回答:
(1)如果选用测定反应物CuO和生成物H2O的质量m(CuO)、m(H2O)时,请用下列仪器设计一个简单的实验方案。

①仪器连接的顺序(用字母编号表示,仪器可重复使用) ,
d中浓硫酸的作用是 。
实验完毕时观察到a中的现象是 。
②列出计算Cu的相对原子质量的表达式 。
③下列情况将使测定结果偏大的是(以下选择不限一个正确答案,均用字母编号填写)
A.CuO未全部还原为Cu B.CuO受潮 C.CuO中混有Cu
(2)如果仍采用上述仪器装置,其他方案可选用测定的物理量有 。
A.m(Cu) 和m(CuO) B.m(N2) 和 m(H2O)
C.m(Cu) 和m(H2O) D.m(NH3) 和 m(H2O)
(一)选择题
1.C 2.A、C 3.D 4.C 5.B、D 6.A 7.C 8.A、D 9.C 10.B 11.A
(二)非选择题
1.(1)过滤;蒸发 (2)B (3)滤液浑浊 (4)液体飞溅 (5)K2CO3,KCl,K2SO4
2.(1)先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却 (2)将反应容器 放在50~60℃的水浴中加热 (3)分液漏斗 (4)除去粗产品中的残留酸 (5)大,苦杏仁
3.(1)除去吸入空气中的CO2 (2)D (3)可增大气体与溶液的接触面,使气体中的CO2被充分吸收;
(4)
(5)把瓶Ⅰ中的NaOH溶液吸入口中;把瓶Ⅱ中的NaOH溶液吹出瓶外
4.(1)增加一种反应物,有利于酯化反应向正反方向进行 (2)蒸出生成物,有利于酯化 反应向正反应方向进行 (3)B (4)除去粗产品中的乙醇 (5)除去粗产品中的水
5.(1)①适当稀释浓H2SO4,防止HBr被氧化 ②吸收溶解的HBr。
(2)②控制恒温,38.4℃。该温度下只有溴乙烷蒸馏出来。
(3)②使沸点高于溴乙烷的副产品回流。
(4)及时分馏出产物,促使平衡正向移动。
(5)密度比水大且难溶于水,水封,防止蒸气逸出,并防止倒吸,E。
6.(1)Ⅱ (2)F,G,E,H 吸收空气中的水蒸气和CO2 (3)F,C (4)A,B,C,F
(5)C2H5OH+CuOCH3CHO+Cu+H2O 乙醛,乙醇 (6)E,G 不合理
7.(1)b,c,a,c,d 吸收未反应的氨,防止空气水分进入 ② 固体由黑色变为红色;③a,c (2)a,c
8.(1)A,B,D,F,G,H,J 坩锅 泥三角 药匙 (2)(W2-W3)/(W2-W1)×100% 偏高 A,D
9.(1)使Fe2+氧化成易于分离的Fe3+
(2)A (3)CuO,Fe(OH)3和过量的CuO
(4)A,B,D,G,I
10.(1)是由于氯水中氢离子与碱中和 (2)是氯水中次氯酸氧化所致。
11.(1)过滤,萃取,Cl2+2I-=I2+2Cl-
(2)B (3)分液漏斗
(4)①缺石棉网 ②温度计插到了液体中 ③冷凝管进出水的方向颠倒
(5)使蒸馏烧瓶受热均匀,控制温度,以防止碘在局部高温时升华。蒸馏烧瓶
12.(1)32g/mol N2H4 (2)N2H4+2CuO2Cu+N2+2H2O
13.(1)把导管b的下端浸于水中,用手握紧试管a,导管会有气泡冒出;松开后,水又会回升到导管b中。 (2)3Cu+8HNO33Cu(NO3)2+2NO↑+4H2O 2NO+O2=2NO2
(3)①铜片上有无色气泡产生,反应速率开始缓慢,后逐渐加快;②试管上部空间由无色变为浅棕色,又变成无色;③试管a中的溶液由无色变为浅蓝色;④反应结束时,铜片全部溶解。(4)由于反应开始时产生的NO和试管a上部空气中的O2作用生成NO2,N O2易溶于水并与水反应,使度管a内气体压强暂时减小,所以导管中的水面会上升到一定 高度
(5)①水进入试管,上升到一定高度;②试管中气体的颜色由棕色变为无色。
14.(1)红棕色 (2)溴与AgNO3反应生成AgBr沉淀,无法确定溴与苯反应有HBr生成
(3 )①吸收烧瓶中的溴蒸气,减少对环境污染 ②与混合液中残余的溴反应,以利于溴苯的提纯 、分离
15.(1)B (2)把该仪器放入冰水里,玻璃管内混合气体颜色变浅;或把该仪器放入热水里, 玻璃管内混合气体颜色变深
16.(1)①c ②a ③检查装置的气密性 本反应为放热反应 ④将系统内的空气排尽 c
(2)①干燥气体 ②使两种气体充分混合 ③观察气泡以调节氢、氮气流速度
NH3及N2、H2的混合物 用蘸有浓盐酸的玻璃棒放在导管口,有白烟说明有氨生成
17.①A,B ②[K+]≥0.2mol/L []=0.1mol/L [] =0.2mol/L
[]=0.4mol/L
18.(1)NaOH、BaCl2、Na2CO3、HCl
(2)2NaCl+2H2O2NaOH+2H2+2Cl2?
(3)干燥的HCl,防止MgCl2?6H2O受热脱水时水解。
aE,C, NaCl+H2SO4(浓) NaHSO4+HCl?
bL⑤、①、②、③、⑦、④、③
cM浓H2S4,稀NaOH,NaCl(s),MgCl2?6H2O,浓H2SO4
d吸收HCl气体,白色酸雾。
19.(1)SOCl2+H2O2HCl+SO2↑
(2)由SOCl2与水反应“剧烈”,可知SOCl2与晶体ZnCl2?3H2O混合共热时,SOCl2就优先于Zn2+与水结合,生成HCl,因而从两个方面抑制ZnCl2水解:
ZnCl2+H2OZn(OH)Cl+HCl,得到无水ZnCl2。
(3)C2H5OH+SOCl2C2H5Cl+SO2↑+HCl↑
(4)由题给信息可知SOCl2的沸点仅为77℃,较低,所以可用蒸馏的方法除去。故选D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com