
题目列表(包括答案和解析)
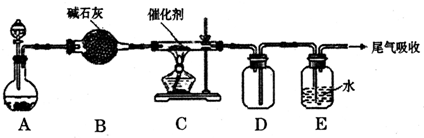
| ||
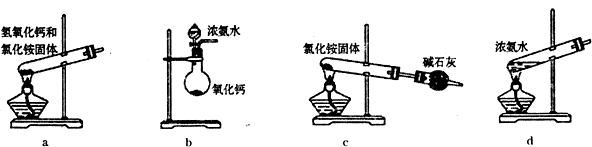
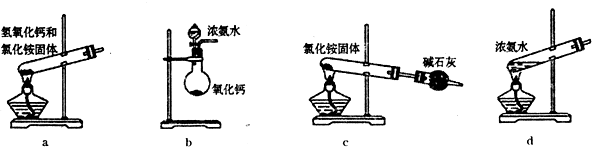
Ⅰ.第一小组对市场上的碘盐进行了研究。在碘盐里,碘以KIO3形式存在。请完成下列问题:
(1)正确食用碘盐才能起到补碘的作用,该小组对油炸食品是否适宜放碘进行了课题研究。
请你协助拟定课题名称:______________________________。
其研究成果的最终形式是:______________________________。
(2)怎样检验碘盐中含有碘?(可供选择的试剂有:稀硝酸、稀盐酸、KCl、KI淀粉溶液、石蕊试液)用离子反应方程式表示______________________________。
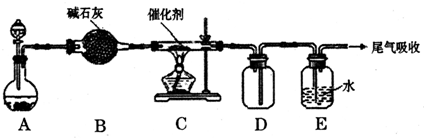
Ⅱ.第二小组利用废铜制取CuSO4:
(1)甲学生进行了下列实验:取含6.4 g铜的废铜和10 mL 18 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶中还有较多的硫酸剩余。你认为他的判断是否正确___________(填“是”或“否”),其理由是:_____________________________________________________。
(2)乙同学认为甲设计的实验方案不好,他自己设计的思路是:
2Cu+O2![]() 2CuO;CuO+H2SO4====CuSO4+H2O。对比甲的方案,乙同学方案的优点是:
2CuO;CuO+H2SO4====CuSO4+H2O。对比甲的方案,乙同学方案的优点是:
_____________________________________________________________________。
(3)某地有丰富的电力源。为了具备乙同学的优点,你能不能根据该地的资源优势也设计一个用铜和硫酸制取CuSO4的方案?(其他材料任选)_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com