
题目列表(包括答案和解析)
 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.

(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=—889.6 kJ/mol
H2O(l)=H2O(g) △H3=+44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4mol A和2 mol B,发生如下反应:
2A(g) + B(g) C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 molB B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 molD D.2 molA、1mol B、1 mol C、1 mol D
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1=" —285.8" kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2=" —889.6" kJ/mol
H2O(l)=H2O(g) △H3=" +44.0" kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H =" Q" kJ·mol-1
C(g) + D(g) △H =" Q" kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
(1)已知: C(s)+O2(g)=CO2(g)???????? ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)? ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= ____? ___kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)? ΔH
CH3OH(g)? ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。

③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25 mol/L,则CO的转化率=?????????? ,此温度下的平衡常数K=????????????? (保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为???????????????????????? 。
(12分)(1)有科学家提出“绿色自由”的构想:将CO2变为燃料或有机化学品。其构想分成3个步骤:
① 利用浓碳酸钾溶液吸收空气中的CO2;
② 将第①步吸收液电解产生H2和O2,同时分离出CO2;
③ 将第②步产生的H2和CO2在一定条件下转化成CH4和水蒸气。
已知:H2(g)+0.5O2(g)=H2O(l) △H1= —285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H2= —889.6 kJ/mol
H2O(l)=H2O(g) △H3= +44.0 kJ/mol
第③步反应的热化学方程式为 。
(2)使用合适的催化剂和电极材料,以N2、H2为原料,以HCl-NH4Cl为电解质溶液构成新型燃料电池,同时达到固氮作用。该电池的正极反应式为 ,溶液中H+向 极移动(选择填写“正”或“负”)。
(3)某催化剂的主要成分是FeO、Fe2O3,当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高。以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C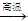 4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
4FeO+CO2。为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为_____g。
(4)在T℃时,向2L固定体积的密闭容器中加入4 mol A和2 mol B,发生如下反应:
2A(g) + B(g)  C(g) + D(g) △H = Q kJ·mol-1
C(g) + D(g) △H = Q kJ·mol-1
当反应达到平衡时,A的转化率为50﹪。
(ⅰ)在一定条件下,反应可以自发向右进行,可知Q __________0 (填“﹤”、“﹥”或“﹦”)。
(ⅱ)维持温度不变,若向该容器中加入的物质及量如下,使起始时v(正)>v(逆)且达到平衡时C的百分含量为20﹪。下列符合要求的是
A.2 mol A、1 mol B B.1 mol He、3 mol A、1.5 mol B、0.5molC、0.5mol D
C.2 mol C、2 mol D D.2 molA、1mol B、1 mol C、1 mol D
15、(10分)
⑴结构式(1分);测定pH 或滴加Na2CO3溶液 或将甲酸滴加到滴有酚酞的NaOH溶液中(不能用Na,其它合理答案均可得分)(2分)
⑵(2分)测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等(合理均可给分)
⑶(2分)出现银镜,由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质(1分。羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型);或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性(1分)
⑷ ① 甲酸在浓硫酸的作用下脱水生成CO和H2O(1分)
 ②(2分)
②(2分)
16、(8分 每空1分)
 (1)
离子键、共价键(或非极性键)
(1)
离子键、共价键(或非极性键)
(2)FeS2 -1 (3)Fe2O3+6H+=2Fe3++3H2O Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4
(4)Cu-2e=Cu2+ (5) 852
17. (12分)(1)SO2+NaOH=NaHSO3 (1分) HSO3-+H+==SO2+H2O (1分)
 (2) AB
(2分) 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量 (2分)
(2) AB
(2分) 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量 (2分)
 (3)变废为肥,充分利用资源,降低污染 (2分)
(3)变废为肥,充分利用资源,降低污染 (2分)
 (4)+4 (2分)
(4)+4 (2分)
 (5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O (2分)
(5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O (2分)
18.(共8分,每空2分)
(1)3NaClO3+3H2SO4=2ClO2↑+HClO4+H2O+3NaHSO4
或 3NaClO3+2H2SO4=2ClO2↑+NaClO4+H2O+2NaHSO4
(2)二氧化硫作为还原剂把ClO2还原为NaClO2
2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O
(3)H2SO4
19.(12分)


 ⑴
(或
),
(2分,各1分)
⑴
(或
),
(2分,各1分)
 ⑵
(2分)
⑵
(2分)

(3分)
⑶ ④、⑤、⑥ (写对一个得一分,错一个扣一分,扣完为止,3分)
⑷ ①、③ (2分,各1分)
20. (10分)(1).2.8×105 ;18
(2).86.96% (3). ;138
;138
21、(12分)⑴分子 (2分) 1s2s22p63s23p63d84s2或[Ar]3d84s2 (2分)
⑵ACD (2分) ⑶①、③、④ (2分) 平面三角 (2分)
⑷LaNi5或Ni5La (2分)
I.将0.050molSO2和0.030molO2放入容积为 2SO3(g)
;△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932 kJ的热量,则容器A中SO2的平衡转化率为
;容器B中SO2的平衡转化率(填“大于”、“小于”或“等于”)
2SO3(g)
;△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932 kJ的热量,则容器A中SO2的平衡转化率为
;容器B中SO2的平衡转化率(填“大于”、“小于”或“等于”)
容器A中SO2的平衡转化率;达到平衡的时间(填“A”或“B”) 容器比较短;
II.滴定分析法是化学分析法中的重要分析方法之一。滴定分析法就是将一种已知准确浓度的试剂溶液(即标准溶液),由滴定管滴加到被测定的物质的溶液(即试液)中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积,就可以求得被测组分的含量。
(1) 已知用0.10 mol/L HCl滴定 20.00ml
0.10 mol/L Na2CO3的滴定曲线如右图所示:
 ① A处选用
作指示剂比较合适;
① A处选用
作指示剂比较合适;
② 当滴定至混合液pH接近4时,为了防止
终点出现过早,减少实验的误差,应剧烈地
摇动溶液或加热一会溶液,冷却后再继续滴
定,这样做的理由是:
;
如果是采用加热溶液的操作,应如何进行?
;
(2)(2)EDTA是乙二胺四乙酸的英文名称的缩写,
它是一种常用的滴定剂,市售试剂是其二水合二钠
盐。下表是EDTA与一些常见金属离子形成络合物
(用MY表示)的稳定常数(温度25oC):
阳离子
lgKMY
阳离子
lgKMY
Na+
1.66
Mn2+
13.87
Ca2+
10.96
Pb2+
18.04
lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离
根据上表给出的数据和你所学的知识,解释为什么用CaY溶液可以排除体内的铅?
___________________________________________________________________________。
23.(12分)
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]为测定硫元素的含量
Ⅰ.将m 2Fe2O3+8SO2
2Fe2O3+8SO2
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
⑴.Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有_________________、_________________。
⑵.Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是_____________。
⑶.该黄铁矿中硫元素的质量分数为______________。
[实验二]设计以下实验方案测定铁元素的含量

问题讨论:
⑷.③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有__________。
⑸.②中,若选用铁粉作还原剂,你认为合理吗?理由是:____________。
五、(本题包括1小题,9分)
25.(9分)
咖啡酸苯乙酯 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:
请填写下列空白。
⑴.D分子中的官能团是________。
⑵.高分子M的结构简式是______________。
⑶.写出A→B反应的化学方程式:___________________。
⑷.B→C发生的反应类型有______________。
⑸.A的同分异构体很多种,其中,同时符合下列条件的同分异构体有____种。
①苯环上只有两个取代基;
②能发生银镜反应;
③能与碳酸氢钠溶液反应;
④能与氯化铁溶液发生显色反应。
(10分)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示:

已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3MnSO4+2NH3↑+CO2↑+H2O。
(1)写出反应②的离子方程式_______________________________________。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、____________、__________。从物料平衡角度看,理论上生产过程中_________(填“需要”或者“不需要”)添加(NH4)2SO4。
(3)向物质的量浓度均为0.01mol?L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是________(填离子符号);当两种沉淀共存时,溶液中 =________。
=________。
[Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11]
(10分)(1)Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓(2分)
(2)NH3、CO2 (2分) 不需要(2分)
(3)Mn2+(2分) 450(2分)
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com