
题目列表(包括答案和解析)
关于热化学方程式:2H2(g)+ O2(g)= 2H2O(l);△H = -571.6kJ·mol-1,下列有关叙述错误的是( )
A.2 mol H2完全燃烧生成液态水时放出571.6kJ的热
B.1 mol H2完全燃烧生成液态水时放出285.8kJ的热
C.2 个H2分子完全燃烧生成液态水时放出571.6kJ的热
D.上述热化学方程式可以表示为:
H2(g)+ 1/2O2(g)= H2O(l);△H = -285.8kJ·mol-1
关于热化学方程式:2H2(g)+ O2(g)= 2H2O(l);△H = -571.6kJ·mol-1,下列有关叙述错误的是( )
A.2 mol H2完全燃烧生成液态水时放出571.6kJ的热
B.1 mol H2完全燃烧生成液态水时放出285.8kJ的热
C.2 个H2分子完全燃烧生成液态水时放出571.6kJ的热
D.上述热化学方程式可以表示为:
H2(g)+ 1/2O2(g)= H2O(l);△H = -285.8kJ·mol-1
下列热化学方程式或离子方程式中,正确的是:
| A.将金属钠加入水中:2Na + 2H2O = 2Na+ + 2 OH- + H2↑ |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 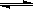 2NH3(g)△H= -38.6kJ·mol-1 2NH3(g)△H= -38.6kJ·mol-1 |
| C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H= -890.3kJ·mol-1 |
| D.氯化镁溶液与氨水反应:Mg2++2 OH-=Mg(OH)2 |
下列热化学方程式或离子方程式中,正确的是( )
| A.氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2 ↓ |
B.500℃、30MPa下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)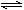 2NH3(g)△H= -38.6kJ·mol-1 2NH3(g)△H= -38.6kJ·mol-1 |
| C.甲烷的标准燃烧热△H= -890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g) + 2O2(g) = CO2(g)+2H2O(g) △H= -890.3kJ·mol-1 |
| D.氧化铝溶于NaOH溶液:Al2O3 + 2OH-=2AlO2-+ H2O |
关于热化学方程式:2H2(g)+02(g)=2H20(1)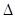 H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
H=-571.6 kJ·mol-1,下列关叙述不正确的是 ( )
A.2mol H2完全燃烧生成液态水放出571.6 kJ的热
B.1mol H2完全燃烧生成液态水时放出285.8kJ的热
C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热
D.上述热化学方程式可表示为H2(g)+1/2
O2(g)=H20(1),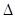 H=-285.8 kJ·mol-1
H=-285.8 kJ·mol-1
1~5。CBBBC 6~9 DADD
10~
19.(8分,除注明的外,每空1分)
(1)丙 95(m2+m3)/
(2)甲 加热蒸发时,MgCl2水解,m2不是MgCl2的质量
(3)乙 偏高 原因是第③步有部分溶液被滤纸吸收,导致Mg(OH)2质量偏大
20.(10分)大试管、酒精灯、计时器(或秒表)(3分);(1)40.8 (2分)
(2)Cl2;湿润的碘化钾淀粉试纸;KClO3与Cr2O3 发生了氧化还原反应 (3分)
氧化铁、氧化铜、二氧化锰等都可作为KClO3受热分解的催化剂或氧化铁的催化能力和二氧化锰的催化能力较好。其他合理也给分(2分)
21.⑴ 测定pH或滴加Na2CO3溶液或将甲酸滴加到滴有酚酞的NaOH溶液中(不应用金属Na)
⑵ 测定HCOONa溶液的pH或将等pH的HCOOH溶液和HCl溶液稀释相同倍数测其pH的变化或比较等浓度甲酸和盐酸的导电性等
⑶ 出现银镜
由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质
⑷ ① 甲酸在浓硫酸的作用下脱水生成CO和H2O
 ②
②
22. . (1)4mol/L(2分); 溶液的密度(1分)
(2)2NaClO3 + SO2 + H2SO4 = 2ClO2 + 2NaHSO4
 或2NaClO3 + SO2 = 2ClO2+Na2SO4(2分)
或2NaClO3 + SO2 = 2ClO2+Na2SO4(2分)
(3)A(1分); (4)BED或ED(2分);重结晶(1分)
23 ..(1)吸热 (2) ①K3= K1/K2 吸热 DE
②Q3=Q1-Q2 (3)
24.(1)有部分KMO4被还原成MnO(OH)2 (1分)
(2)可在水浴中加热 (1分)
(3)A (1分)
(4)酸式滴定管(2分),当最后滴下1滴KMnO4溶液后半分钟不褪色时(1分) 10w/63V (2分)偏高 (2分)
25.(8分)
(1)V2O5 + H2SO4 = (VO2)2SO4 + H2O(2分)
(2)2 1 2H+ → 2 2 2 H2O;(2分) a(1分)
(3) 0.8190 或 81.90% (3分,有效数字错误扣1分)
26.⑴ 取代反应 消去反应 加成反应
⑵
⑶ ④ 保护A分子中C=C不被氧化 
(4)
27.(1)使反应物充分接触,增大反应速率。(2)降低MnSO4的溶解度。
(3)稀硫酸 甲苯 (4)蒸馏 利用甲苯和苯甲醛的沸点差异使二者分离
(5)部分苯甲醛被氧化成苯甲酸。
28.(10分)
(1)1s22s22p63s23p1 (1分) (2) LiH (1分) CH4、NH3、HF、H2O(全对给2分) E分子间不能形成氢键(1分) 原子晶体(1分)
(3)15 (2分)
(4)KC8 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com