
题目列表(包括答案和解析)
75℃左右在有催化剂作用下,乙炔可水化为乙醛。但催化剂遇到某些特定物质(如硫化氢)常会发生催化剂中毒而失去催化作用。现用如下装置图(仪器的支架已略去)制乙醛,请回答以下问题:
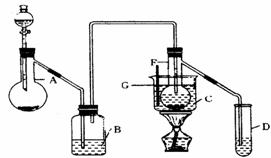
⑴试验开始时,仪器A中放入电石,为了使乙炔气流平稳,分液漏斗中常加入___________代替水;B中应装入______,其作用是_______ ________。
⑵ 装置图中,加热F时所选用的温度计G的量程表示正确的是__ ______(填代号)。
A、0―50℃ B、0―100℃ C、0―200℃ D、0―360℃
⑶本试验常用HgSO4做催化剂;现实验室只有浓硫酸、水、氧化汞粉末,若将三者分别直接加入蒸馏烧瓶F中,应先将_________________加入到F中,其操作方法是___________________;再按先后顺序分别将____________和_______________加入到F中。
⑷D中盛有水,用来吸收生成的乙醛。常用银镜反应来检验乙醛的存在,请写出该反应的化学方程式:___________________
在试验过程中,银镜将在试管的_________(填“上部”、“中部”、“下部”)首先出现;实验结束后,需用_____________清洗试管。
A.NaH2PO4和Na2HPO4溶液的浓度均为0.2 mol·L-1
B.Na2HPO4和NaH2PO4溶液的浓度均为0.125 mol·L-1
C.0.15 mol·L-1的Na2HPO4和0.10 mol·L-1的NaH2PO4
D.0.1 mol·L-1的Na2HPO4和0.1 mol·L-1的Na3PO4
(1)判断混合气体是否能完全燃烧。
(2)总体积减少100 mL后,所得气体是什么?有多少毫升?
(3)共生成CO2多少毫升?最后剩余125 mL气体是什么?
(4)原混合气体中各有多少毫升?
(1)判断混合气体是否能完全燃烧。
(2)总体积减少100 mL后,所得气体是什么?有多少毫升?
(3)共生成CO2多少毫升?最后剩余125 mL气体是什么?
(4)原混合气体中各有多少毫升?
1~5。CBBBC 6~9 DADD
10~
19.(8分,除注明的外,每空1分)
(1)丙 95(m2+m3)/
(2)甲 加热蒸发时,MgCl2水解,m2不是MgCl2的质量
(3)乙 偏高 原因是第③步有部分溶液被滤纸吸收,导致Mg(OH)2质量偏大
20.(10分)大试管、酒精灯、计时器(或秒表)(3分);(1)40.8 (2分)
(2)Cl2;湿润的碘化钾淀粉试纸;KClO3与Cr2O3 发生了氧化还原反应 (3分)
氧化铁、氧化铜、二氧化锰等都可作为KClO3受热分解的催化剂或氧化铁的催化能力和二氧化锰的催化能力较好。其他合理也给分(2分)
21.⑴ 测定pH或滴加Na2CO3溶液或将甲酸滴加到滴有酚酞的NaOH溶液中(不应用金属Na)
⑵ 测定HCOONa溶液的pH或将等pH的HCOOH溶液和HCl溶液稀释相同倍数测其pH的变化或比较等浓度甲酸和盐酸的导电性等
⑶ 出现银镜
由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质
⑷ ① 甲酸在浓硫酸的作用下脱水生成CO和H2O
 ②
②
22. . (1)4mol/L(2分); 溶液的密度(1分)
(2)2NaClO3 + SO2 + H2SO4 = 2ClO2 + 2NaHSO4
 或2NaClO3 + SO2 = 2ClO2+Na2SO4(2分)
或2NaClO3 + SO2 = 2ClO2+Na2SO4(2分)
(3)A(1分); (4)BED或ED(2分);重结晶(1分)
23 ..(1)吸热 (2) ①K3= K1/K2 吸热 DE
②Q3=Q1-Q2 (3)
24.(1)有部分KMO4被还原成MnO(OH)2 (1分)
(2)可在水浴中加热 (1分)
(3)A (1分)
(4)酸式滴定管(2分),当最后滴下1滴KMnO4溶液后半分钟不褪色时(1分) 10w/63V (2分)偏高 (2分)
25.(8分)
(1)V2O5 + H2SO4 = (VO2)2SO4 + H2O(2分)
(2)2 1 2H+ → 2 2 2 H2O;(2分) a(1分)
(3) 0.8190 或 81.90% (3分,有效数字错误扣1分)
26.⑴ 取代反应 消去反应 加成反应
⑵
⑶ ④ 保护A分子中C=C不被氧化 
(4)
27.(1)使反应物充分接触,增大反应速率。(2)降低MnSO4的溶解度。
(3)稀硫酸 甲苯 (4)蒸馏 利用甲苯和苯甲醛的沸点差异使二者分离
(5)部分苯甲醛被氧化成苯甲酸。
28.(10分)
(1)1s22s22p63s23p1 (1分) (2) LiH (1分) CH4、NH3、HF、H2O(全对给2分) E分子间不能形成氢键(1分) 原子晶体(1分)
(3)15 (2分)
(4)KC8 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com