
题目列表(包括答案和解析)
| 现象(至少四个) | 结论 |
| 1.金属钠浮在水面上. 2.熔成小球. 3.小球四处游动,发出嘶嘶声. 4.溶液变成红色 5.Na消失 1.金属钠浮在水面上. 2.熔成小球. 3.小球四处游动,发出嘶嘶声. 4.溶液变成红色 5.Na消失 |
1钠的密度小于水; 2.Na的熔点低,反应放热; 3.生成H2 4.生成NaOH 1钠的密度小于水; 2.Na的熔点低,反应放热; 3.生成H2 4.生成NaOH |


 已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
| O | 2- 7 |
| O | 2- 7 |
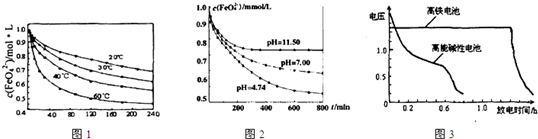
| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
| c(CO) |
| c(CO2) |
| c(CO) |
| c(CO2) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com