某同学从《化学教育》杂志中得知:冶金工业可用金属单质与某种金属氧化物反应的原理来制备另一种金属单质.
【提出假设】金属都能用上述原理进行相互间制备.
【查阅资料】(1)大多数金属氧化物都能与盐酸反应.
(2)下表列出的是一些物质溶于水后的水溶液的颜色.
| 物质名称 |
氯化铝 |
氯化铁 |
氯化铜 |
| 水溶液颜色 |
无色 |
黄色 |
蓝绿色 |
【实验过程及现象】(以下各组物质均能恰好完全反应)
| 实验组别 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
Ⅴ |
Ⅵ |
Ⅶ |
| 药品 |
金属单质 |
Al |
Mg |
Zn |
Fe |
Zn |
Al |
Cu |
| 氧化物 |
CuO |
CuO |
CuO |
CuO |
Fe2O3 |
Fe2O3 |
Fe2O3 |
| 实验现象 |
取上述粉末状的混合物于密闭试管中高温加热 |
爆炸 |
爆炸 |
变红 |
变红 |
变黑 |
变黑 |
无变化 |
| 冷却后,向上述反应后的固体中加入足量的稀盐酸 |
-- |
-- |
固体部分溶解,水溶液呈无色 |
固体部分溶解,水溶液呈黄色 |
固体全部溶解,有气体放出,水溶液呈浅绿色 |
? |
-- |
根据表格内容,回答下列问题:
(1)写出VI中画“?”的实验现象______.
(2)结合V中的所有实验现象,写出其中的两个反应的化学方程式______.
(3)从I~IV的实验中,可发现的规律是______.
(4)冶炼金属除需要“高温”外,还需遵循的规律是______.

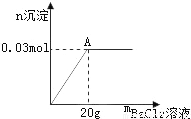
 氯化铝和硫酸铝固体混合物12克,常温下溶解在足量的水中,向溶液中逐滴加入氯化钡溶液.加入氯化钡溶液的质量与生成沉淀的物质的量的关系如图.
氯化铝和硫酸铝固体混合物12克,常温下溶解在足量的水中,向溶液中逐滴加入氯化钡溶液.加入氯化钡溶液的质量与生成沉淀的物质的量的关系如图.