
题目列表(包括答案和解析)
酶的催化能力受各种因素的影响,如温度、酸碱度等。为了验证酸碱度对唾液淀粉酶的影响,小芳进行了如下探究:
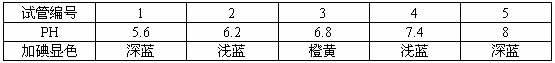
第一步:在5支洁净的试管中,各加入浆糊2毫升,并依次编号为1~5;
第二步:向每个试管中加入一定浓度的溶液2毫升,使1~5号试管中的PH值分别为5.6 、6.2 、6.8 、7.4 、8;
第三步:在各试管中加入略微稀释了的唾液2毫升;
第四步:然后各试管置于37℃的恒温水浴锅中进行水浴;
第五步:间隔一段时间后,
探究结果如表所示:
(说明:溶液的酸碱性强弱程度常用PH值表示。PH值的范围在0-14之间,小于7为酸性,大于7为碱性,等于7为中性。)
请根据上表回答下列问题:
(1)请你帮小芳将第五步探究步骤补充完整。
__________________________________________________________________________。
(2)探究过程中所用的水浴锅,为什么要选择37℃的恒温?
__________________________________________________________________________。
(3)3号试管加碘液出现橙黄色,说明了什么?
__________________________________________________________________________。
(4)根据上述实探究过程及结果可以得出怎样的结论?
__________________________________________________________________________。
实验室有一标签残缺的盐酸,请你来探究。
(1)若确定它不是浓盐酸的方法是 。
(2)粗略测定每毫升盐酸中含溶质HCl的质量。同学们依据酸和碱中和反应的原理,设计了一种可行的实验方案,其操作步骤如下:
第一步:在小烧杯中加入8g5%的氢氧化钠溶液;滴入2滴酚酞试液;
第二步:向10mL的量筒里注入该盐酸至一定刻度,记下读数V1;
第三步:用胶头滴管吸取量筒中的盐酸,逐滴滴入上述烧杯中,直至到溶液由红色刚刚变为无色为止;
第四步:记录并整理数据;
第五步:计算,确定每毫升盐酸中含溶质HCl的质量。
请根据以上实验过程,回答下面问题:
① 写出盐酸和氢氧化钠发生中和反应的化学方程式 。
② 本实验要用指示剂的目的是 。
③ 第三步的操作缺少两个重要环节,请你补充完整。
、 。
④ 如量筒中剩余盐酸的体积为V2 mL,则每毫升盐酸中含溶质HCl的质量是
g。
(3)测定每毫升盐酸中含溶质HCl的质量的方法还有许多,请你写出一种其他可行的方法。(要求:与上述方法的原理不同、简述所依据的原理和要测定的数据。)
| 0.365 |
| v1-v2 |
| 0.365 |
| v1-v2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com