
题目列表(包括答案和解析)
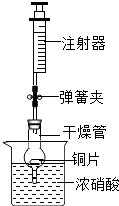
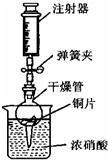


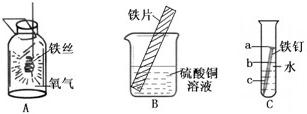
 在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:
在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:| 试管编号 | 1 | 2 | 3 |
| 反 应 物 | Zn片+稀H2SO4 | Fe片+稀H2SO4 | Cu片+稀H2SO4 |
| 反应现象 | 气泡多、大、上升快 | 气泡细小,上升慢 | 没有气泡 |
| Na | Cu | Al | Fe | |
| 熔点(℃) | 97.5 | 1083 | 660 | 1535 |
| 沸点(℃) | 883 | 2595 | 2200 | 3000 |
| 你的一种猜想 | 验证方法 | 现象 | 结论 |
| 金属R的活动性比铁 _______ | 将金属R投入 _______溶液中 | 金属R表面有黑色的物质析出 | 猜想 _______ (选填“正确”或“错误”) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com