
题目列表(包括答案和解析)
 (7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.
(7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%.老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种.| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ |
25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
(7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%。老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。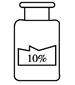
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙溶液,理由是 。
(2)小亮取少量样品于试管中,滴加 试液,试液变红色,该溶液不可能是 。
(3)为了进一步确定该溶液的成分,小亮设计了以下实验方案:
方案A:选择稀盐酸来确定该溶液的成分;
方案B:选择无色酚酞试液来确定该溶液的成分;
你认为以上方案中合理的是 ,若选择一种常见的碱溶液来确定,有关反应
的化学方程式为 。
(4)小亮通过上述方法证明该溶液的成分为NaOH,于是他取一定体积的NaOH溶液
(20℃),并向其中滴加10%的盐酸(20℃),测得反应中溶液的温度与加入盐酸体积的变化如下。
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度 (t)/℃ | 25.2 | 29.6 | 32.0 | 36.0 | 38.2 | 36.7 | 35.7 | 34.7 | 33.7 | 32.9 |
(7分)小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质质量分数为10%。老师说,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠中的一种。

(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙溶液,理由是 。
(2)小亮取少量样品于试管中,滴加 试液,试液变红色,该溶液不可能是 。
(3)为了进一步确定该溶液的成分,小亮设计了以下实验方案:
方案A:选择稀盐酸来确定该溶液的成分;
方案B:选择无色酚酞试液来确定该溶液的成分;
你认为以上方案中合理的是 ,若选择一种常见的碱溶液来确定,有关反应
的化学方程式为 。
(4)小亮通过上述方法证明该溶液的成分为NaOH,于是他取一定体积的NaOH溶液
(20℃),并向其中滴加10%的盐酸(20℃),测得反应中溶液的温度与加入盐酸体积的变化如下。
|
加入盐酸的体积(V)/mL |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
|
溶液温度 (t)/℃ |
25.2 |
29.6 |
32.0 |
36.0 |
38.2 |
36.7 |
35.7 |
34.7 |
33.7 |
32.9 |
根据上表分析溶液温度变化的原因:
①加入盐酸的量在2~10 mL之间时 。
②加入盐酸的量在10~20 mL之间时 。
| A.胃液中含盐酸的质量分数明显小于0.37% |
| B.胃液与血液都呈酸性 |
| C.pH与溶液的H+离子浓度之间呈正比例关系 |
| D.人体的血液呈弱碱性 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com