
题目列表(包括答案和解析)
| 质量分数不同的硫酸溶液其密度不相同,对照表如下: | ||||||||||||||||||||||
(1)10mL98%的浓硫酸中含 gH2SO4。 (2)列式计算消耗金属锌的质量。 (3)分析表中数据,可以归纳出硫酸溶液的质量分数与密度的关系是 质量分数越大密度越大 。10mL水和10mL质量分数为b%的硫酸溶液混合,混合后溶液的质量分数应该在 % 至 % 之间。 |
质量分数不同的硫酸溶液其密度不相同,对照表如下:
| 质量分数 | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 98% |
| 密度(g/mL) | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
将10mL98%浓硫酸中加水稀释至100ml,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10mL98%的浓硫酸中含 -----gH2SO4。
(2)列式计算消耗金属锌的质量。
质量分数不同的硫酸溶液其密度不相同,对照表如下:
| 质量分数 | 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 98% |
| 密度(g/mL) | 1.07 | 1.14 | 1.22 | 1.30 | 1.40 | 1.50 | 1.61 | 1.73 | 1.81 | 1.84 |
将10mL98%浓硫酸中加水稀释至100ml,取10mL该稀硫酸与足量锌反应制取氢气,请按要求完成系列问题的解答(计算结果保留一位小数):
(1)10mL98%的浓硫酸中含 gH2SO4。
(2)列式计算消耗金属锌的质量。
 质量守恒定律的定量研究对化学科学发展具有重大作用。
质量守恒定律的定量研究对化学科学发展具有重大作用。
(1) 黑火药点燃时发生如下反应:2KNO3+S+3C 
 K2S+3CO2↑+X↑,其中X的化学式为 。
K2S+3CO2↑+X↑,其中X的化学式为 。
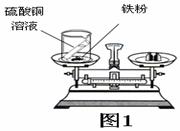
(2)如右图1装置中,称量小烧杯及烧杯内所有物质的总质量为m1 ,然后将小烧杯中的硫酸铜溶液和铁粉完全混合,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m2 ,则(填“=”“>”“<”)m1 m2 。
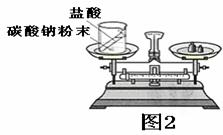 (3)如右图2装置中,称量小烧杯及烧杯内所有物质的总质量为m1 ,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m2 ,则(填“=”“>”“<”)m1 m2 ,其原因为 。
(3)如右图2装置中,称量小烧杯及烧杯内所有物质的总质量为m1 ,然后将小烧杯中的碳酸钠与盐酸完全混合,反应发生了一段时间后,再称量小烧杯及烧杯内物质的总质量为 m2 ,则(填“=”“>”“<”)m1 m2 ,其原因为 。
(4)由此可知,在化学反应前后,一定不变的是 (填序号)。
① 原子种类 ② 原子数目  ③分子种类
③分子种类
④ 分子数目 ⑤元素种类 ⑥ 物质的总质量
(5)在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。则关于此反应的认识不正确的是( )
| 物 质 | X | Y | Z | W |
| 反应前的质量(g) | 2 | 1 | 16 | 16 |
| 反应后的质量(g) | 17 | m | 6 | 11 |
A.物质Y可能是该反应的催化剂 B.该反应的基本类型为分解反应
C.参加反应的Z与 W的质量比为2︰3 D.反应后容器中Z与Y的质量比为6︰1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com