
题目列表(包括答案和解析)
| ||
| ||

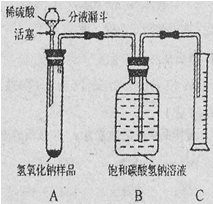
同学们在实验室用5%的过氧化氢溶液制取氧气并进行氧气部分性质实验,具体操作如下:
(1)溶液配制:用50mL 30%的过氧化氢溶液配制5%的过氧化氢溶液.溶液配制过程中,除用到玻璃棒外,还需用到下列仪器中的
A、托盘天平 B、烧杯 C、漏斗 D、量筒 E、胶头滴管
(2)气体制备:用配制好的5%的过氧化氢溶液和二氧化锰制取氧气.请你在如图1A、B两套装置中选择其中一套,并说明选择的理由: (合理即可).
(3)性质实验:小明用收集好的氧气,进行了铁丝燃烧的实验.实验前,它在集气瓶底部 ,然后把光亮的细铁丝盘成螺旋状,在铁丝下端系一根火柴,将火柴点燃,待火柴快燃尽时,缓慢插入集气瓶中,观察到的现象是 .
(4)拓展延伸:小亮同学在上述制取氧气的实验过程中,不小心把硫酸铜溶液滴加到了盛有5%的过氧化氢溶液中,立即产生大量气泡,于是引起了小亮同学的探究兴趣.
【提出问题】是哪种粒子能使过氧化氢分解的速率加快呢?
【查阅资料】硫酸铜溶液中含有三种粒子:H2O、SO42﹣、Cu2+
【猜想与假设】Ⅰ、不可能是H2O,理由是 ;
Ⅱ、可能是SO42﹣;
Ⅲ、可能是Cu2+.
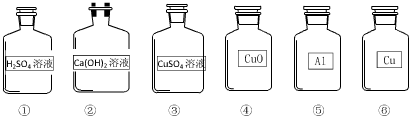
【实验验证】如图2所示:
在实验①中加入稀硫酸后,无明显变化,说明 不能使过氧化氢的分解速率加快;
在实验②中加入 后,观察到有大量气泡产生,进一步证明能使过氧化氢分解速率加快的是 .
【结论】实验证明,硫酸铜在该反应前后的质量和化学性质都没有发生变化,硫酸铜是过氧化氢分解的催化剂.
【反思与交流】Ⅰ、检验实验②中产生气体的方法是 ;
Ⅱ、写出过氧化氢在硫酸铜催化作用下发生反应的化学方程式 .
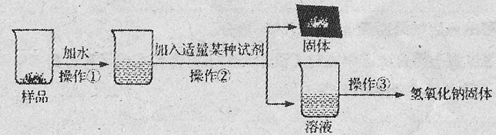
(15分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3。
则NaOH变质反应的化学方程式为 。
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 ; | 白色沉淀产生 | 该反应的化学方程式: ; |
| (2)将上述反应后的混合物过滤,取滤液加入 。 | 。 | 证明猜想Ⅱ正确 |
| 实验步骤 | 现象 | 结论 |
| ______ ______ | 木条不复燃 | 该气体不是氧气 |
| 收集一试管气体,用拇指堵住管口,移近酒精灯火焰 | 发出轻微的爆鸣声,并产生淡蓝色火焰 | 该气体是______ |

 (填序号)试剂进行实验。
(填序号)试剂进行实验。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com