
题目列表(包括答案和解析)
| 实验步骤 | 实验现象 | 实验结论 |
| ①在试管中加入5mL15%的“双氧水” ②滴入适量的FeCl3溶液 ③把带火星木条伸入试管 |
FeCl3溶液可以催化分解过氧化氢 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①向盛有5mL15%的“双氧水”的试管中加入少量盐酸,然后把带火星木条伸入试管 | 无明显现象 | |
| ②向盛有5mL15%的“双氧水”的试管中加入少量 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①在试管中加入5mL15%的“双氧水” ②滴入适量的FeCl3溶液 ③把带火星木条伸入试管 | FeCl3溶液可以催化分解过氧化氢 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①向盛有5mL15%的“双氧水”的试管中加入少量盐酸,然后把带火星木条伸入试管 | 无明显现象 | ______ |
| ②向盛有5mL15%的“双氧水”的试管中加入少量______溶液,然后把带火星木条伸入试管 | ______ | ______ |
在一次化学课外活动课上,老师给同学们一包可能是碳酸钠、硫酸钠或是两者混合物的白色固体物质,让他们通过实验探究来确定其成分.小明同学的探究过程如下:
(1)[提出假设]假设1:白色固体物质是碳酸钠;
假设2:________;
假设3:________.
(2)[设计实验方案]他对实验做了如下的设想和分析:
取少量白色固体物质在烧杯中溶解,并依次加入过量稀盐酸和几滴氯化钡溶液.则实验中可能出现的现象及对应结论如下表,请你完成下表:

| ||
| ||

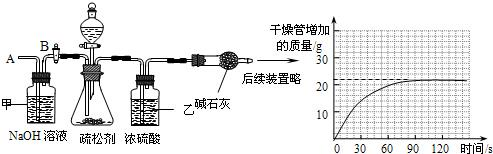
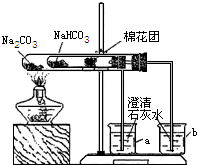 某校同学对市场上的食品疏松剂进行了如下探究.
某校同学对市场上的食品疏松剂进行了如下探究.| 成分 | 所用物质 |
| 碳酸盐类 | 碳酸氢钠 |
| 酸性物质 | 柠檬酸、酒石酸等 |
| 疏松剂 | 明矾 |
| 其他成分 | 淀粉、脂肪酸等 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com