
题目列表(包括答案和解析)
写出下列仪器的名称和用途。
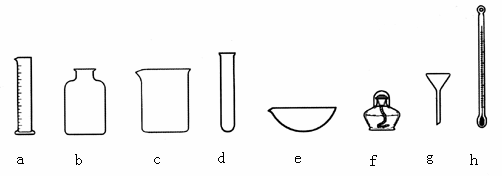
(1)
名称:a________,b________,c________,d________,e________,f________,g________,h________。(2)
可直接在火焰上加热的是________(填写编号,下同),加热时必须垫石棉网的是________,用于量取液体体积的是________,可用于配制溶液的是________。(本题共12分)
已知:
| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 正丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
 根据题意完成下列填空:
根据题意完成下列填空:
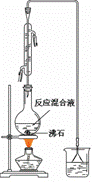
(一)制备1-溴丁烷粗产品
在右图装置的圆底烧瓶中依次加入NaBr,10 mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30 min。
(1)写出制备1-溴丁烷的化学反应方程式:
__________________________________________________
(2)反应装置中加入沸石的目的是__________________。
配制体积比为1:1的硫酸所用的定量仪器为 (选填编号)。
a.天平 b.量筒 c.容量瓶 d.滴定管
(3)反应装置中,除了产物和水之外,还可能存在 、 等有机副产物。
(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是 (选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
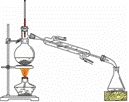 (二)制备精品
(二)制备精品
将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按右图装置蒸馏。
(5)收集产品时,控制的温度应在_________℃左右;
区分1-溴丁烷精品和粗品的一种方法是____________________。
(6)实验制得的1-溴丁烷的质量为10.895 g,则正丁醇的转化率为 。(保留3位小数)。
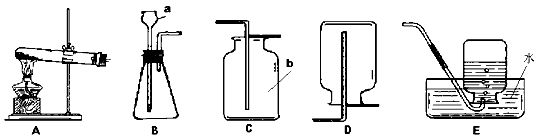
根据下列装置图回答问题。
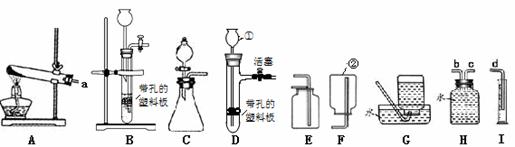
Ⅰ.写出仪器①的名称是 ⑻ ,仪器②的名称 ⑼ 。
Ⅱ.实验室用一定质量的氯 酸钾制取氧气,通过排水量测定所收集到的氧气体积。
酸钾制取氧气,通过排水量测定所收集到的氧气体积。
①写出该反应的化学方程式 ⑽ 。
②若各装置的连接顺序是:a→b→c→d,H装置内导管(“b”或“c”)该怎样延伸?请画出⑾ 。
③根据氯酸钾的质量算出的氧气体积为理论值.如果实际测得氧气的体积大于理论值(水的体积测量准确),你认为原因是 ⑿ 。
Ⅲ.某兴趣小组为了选择实验室制取二氧化碳的原料,对影响盐酸与大理石(大理石中杂质不与盐酸反应)反应的速率快慢的因素展开研究。
提出假设:盐酸与大理石反应的速率快慢与所用HCl的质量分数、大理石颗粒大小有关。
实验设计与实施:
| 实验编号 | 温度 | 5克大理石(碳酸钙纯度相同)规格 | 20克HCl的质量分数 | 完全反应所需时间/s |
| 实验① | 20℃ | 粗颗粒 | 20% | 140 |
| 实验② | 20℃ | 粗颗粒 | 10% | 220 |
| 实验③ | 20℃ | 细颗粒 | 20% | 30 |
根据以上信息回答下列问题:
写出上述实验中反应的化学方程式 ⒀ 。
实验①与②的目的是为了探究 ⒁ 。
实验 ⒂ (填实验编号)的目的是为了探究大理石颗粒粗、细对反应快慢的影响。
实验结论:HCl质量分数越大,反应越快;固体的颗粒越小,反应越快。
拓展与反思:还有哪些因素可能影响该反应的速率快慢呢?请写出你的一个猜想: ⒃ 。
根据上述实验探究,实验室选用块状大理石与稀盐酸制取二氧化碳,选用上图中具有启普发生器原理 的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
的 ⒄ (填编号)装置作为制取二氧化碳的发生装置。
Ⅳ.实验室在常温下用块状电石固体与水反应制取乙炔气体, 该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
该反应必须严格控制加水速度,以免剧烈反应引起发生装置炸裂;乙炔是一种微溶于水且密度比空气略小的气体。上图中制取较纯乙炔的最适宜发生和收集装置是 ⒅ (填编号,除装置H和I外)。
 请结合图回答问题:
请结合图回答问题:
① 写出图中a、b仪器的名称:a(1),b (2);
② 实验室用加热氯酸钾和二氧化锰的混合物制取氧气,其发生装置是(3)(填编号),写出反应的化学方程式(4);
③实验室用锌粒和稀硫酸在常温下反应制取氢气,为了能控制反应的发生或停止,选用的发生装置是(5)(填编号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com