
题目列表(包括答案和解析)
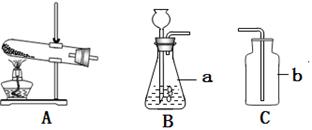
图所示为实验室常用的实验装置,据此回答下列问题:
(1)写出标号所示仪器的名称
b 。
 |
(2)实验室用高锰酸钾制取氧气的反应表达式为 。
小明同学打算从制取O2后的固体残渣中回收二氧化锰(固体残渣中只有MnO2不溶于水)的方法是溶解、 、洗涤并干燥。
(3)收集二氧化碳只能用C装置的原因是 。
(4)小雯发现在加热硬水的过程中,产生了一种难溶性的固体。
提出猜想: 难溶性的固体可能是碳酸钙。向这种难溶性的固体中滴入稀盐酸稀盐酸
,观察到有大量的气泡产生,则这种固体可 能是碳酸钙;若这种固体是碳酸钙,写出该反应的表达式 CaCO3+2HCl═CaCl2+H2O+CO2↑。
能是碳酸钙;若这种固体是碳酸钙,写出该反应的表达式 CaCO3+2HCl═CaCl2+H2O+CO2↑。
 (5)下图是小雯用这种固体制取CO2,并验证CO2性质的实验组合装置,根据装置解答下列问题:
(5)下图是小雯用这种固体制取CO2,并验证CO2性质的实验组合装置,根据装置解答下列问题:
①方框中的发生装置应选择本题上右图中 (选填:A、B)装置;
②在装置D中可观察到的实验现象是:___ __,其相关的反应表达式为: ;
③装置E通常用于实验室检验CO2气体,现象是:________ _____________;
④装置F中可观察到奇妙的现象,从而说明CO2可用于:________  _____________;
_____________;
⑤实验室要制取NO2气体做微粒运动的演示实验。NO2是一种红棕色的气体,密度比空气大,易被氢氧化钠溶液吸收,能与水反应生成硝酸和NO;NO2和NO都有毒,易污染环境。
Ⅰ.收集NO2可用如图1所示的装置,NO2应从端__ __(填“a”或“b”)通入。
Ⅱ.实验室通常在收集装置后还连接一套图2所示的装置,你认为这套装置的主要作用是:
Ⅲ.如图3,做微粒运动演示实验时,为缩短演示时间,NO2最好盛放在 (填“上”或“下”)面的集气瓶中,另一瓶放空气。抽去玻璃片可看到: 。
 |
(14分)如图所示为实验室常用的实验装置,据此回答下列问题:
(1)写出标号所示仪器的名称b 。
(2)实验室用高锰酸钾制取氧气的反应表达式为 。
小明同学打算从制取O2后的固体残渣中回收二氧化锰(固体残渣中只有MnO2不溶于水)的方法是溶解、 、洗涤并干燥。
(3)收集二氧化碳只能用C装置的原因是 。
(4)小雯发现在加热硬水的过程中,产生了一种难溶性的固体。提出猜想: 难溶性的固体可能是碳酸钙。向这种难溶性的固体中滴入稀盐酸稀盐酸,观察到有大量的气泡产生,则这种固体可能是碳酸钙;若这种固体是碳酸钙,写出该反应的表达式 。
(5)如图是小雯用这种固体制取CO2,并验证CO2性质的实验组合装置,根据装置解答下列问题:
①方框中的发生装置应选择本题上右图中 (选填:A、B)装置;
②在装置D中可观察到的实验现象是:___ __,其相关的反应表达式为: ;
③装置E通常用于实验室检验CO2气体,现象是:________ _____________;
④装置F中可观察到奇妙的现象,从而说明CO2可用于:________ _____________;
⑤实验室要制取NO2气体做微粒运动的演示实验。NO2是一种红棕色的气体,密度比空气大,易被氢氧化钠溶液吸收,能与水反应生成硝酸和NO;NO2和NO都有毒,易污染环境。
Ⅰ.收集NO2可用如图1所示的装置, NO2应从端__ __(填“a”或“b”)通入。
Ⅱ.实验室通常在收集装置后还连接一套图2所示的装置,你认为这套装置的主要作用是:
Ⅲ.如图3,做微粒运动演示实验时,为缩短演示时间,NO2最好盛放在 (填“上”或“下”)面的集气瓶中,另一瓶放空气。抽去玻璃片可看到: 。
(14分)如图所示为实验室常用的实验装置,据此回答下列问题:

(1)写出标号所示仪器的名称b 。
(2)实验室用高锰酸钾制取氧气的反应表达式为 。
小明同学打算从制取O2后的固体残渣中回收二氧化锰(固体残渣中只有MnO2不溶于水)的方法是溶解、 、洗涤并干燥。
(3)收集二氧化碳只能用C装置的原因是 。
(4)小雯发现在加热硬水的过程中,产生了一种难溶性的固体。提出猜想: 难溶性的固体可能是碳酸钙。向这种难溶性的固体中滴入稀盐酸稀盐酸,观察到有大量的气泡产生,则这种固体可能是碳酸钙;若这种固体是碳酸钙,写出该反应的表达式 。
(5)如图是小雯用这种固体制取CO2,并验证CO2性质的实验组合装置,根据装置解答下列问题:

①方框中的发生装置应选择本题上右图中 (选填:A、B)装置;
②在装置D中可观察到的实验现象是:___ __,其相关的反应表达式为: ;
③装置E通常用于实验室检验CO2气体,现象是:________ _____________;
④装置F中可观察到奇妙的现象,从而说明CO2可用于:________ _____________;
⑤实验室要制取NO2气体做微粒运动的演示实验。NO2是一种红棕色的气体,密度比空气大,易被氢氧化钠溶液吸收,能与水反应生成硝酸和NO;NO2和NO都有毒,易污染环境。

Ⅰ.收集NO2可用如图1所示的装置, NO2应从端__ __(填“a”或“b”)通入。
Ⅱ.实验室通常在收集装置后还连接一套图2所示的装置,你认为这套装置的主要作用是:
Ⅲ.如图3,做微粒运动演示实验时,为缩短演示时间,NO2最好盛放在 (填“上”或“下”)面的集气瓶中,另一瓶放空气。抽去玻璃片可看到: 。


课外化学兴趣小组的同学利用某化工厂的废碱液(主要成分为Na2CO3、还含有少量NaCl,其它杂质不计)和石灰乳(氢氧化钙的悬浊液)为原料制备烧碱,并对所得的烧碱粗产品的成分进行分析和测定。
【粗产品制备】
(1)将废碱液加热蒸发浓缩,形成较浓的溶液,冷却后与石灰乳混合,发生反应的化学方程式为 ▲ 。
(2)将反应后的混合物过滤,得到的滤液进行蒸发结晶,制得NaOH粗产品。
【粗产品成分分析】
(1)取适量粗产品溶于水,加入Ba(NO3)2溶液出现白色浑浊,发生反应的化学方程式为 ▲ ,该粗产品中一定不含有 ▲ ,理由是 ▲ 。
(2)该小组同学通过对粗产品成分的实验分析,确定该粗产品中含有三种物质。
【粗产品含量测定】
Na2CO3含量的测定:
(1)该兴趣小组的同学设计了下图所示的实验装置。取20.0g粗产品,进行实验。

【说明】①碱石灰是CaO与NaOH的固体混合物。
②E装置中的饱和NaHCO3溶液是为了除去二氧化碳气体中的氯化氢,发生
的反应为:NaHCO3+ HCl = NaCl + CO2 ↑ + H2O。
(2)操作步骤
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量G的质量;
④关闭弹簧夹C,慢慢滴加浓盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次缓缓通入一段时间空气;
⑥再次称量G的质量,得前后两次质量差为4.8g。
(3)问题探究
①F中的试剂应为 ▲ 。
②B装置的作用是 ▲ ,H装置的作用是 ▲ 。
③若没有H装置,则测定的Na2CO3的质量分数会 ▲ (填“偏大”、“偏小”、“不变”)。
事实上20.0 g粗产品只能产生4.4 g CO2 。请你仔细分析上述实验,解释实验值4.8g比正确值4.4 g偏大的原因(假设操作均正确) ▲ 。
(4)数据计算
根据正确值4.4 g可求得粗产品中Na2CO3的质量分数为 ▲ %。
NaOH含量的测定:
该小组同学又另取20.0g粗产品,逐滴加入20%的盐酸至恰好完全反应时,消耗盐酸的质量为73 g,放出CO2 4.4 g(不考虑二氧化碳气体的溶解)。求原粗产品中NaOH的质量分数。(写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com