
题目列表(包括答案和解析)
过氧化氢是一种无色液体,易分解为水和氧气,常用作氧化剂、漂白剂和消毒剂,为了贮存、运输、使用方便,工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3?H2O2)该晶体具有碳酸钠和过氧化氢的双重性质。下列方法不会使过氧化钠失效的是( )
A.与二氧化锰接触 B.与盐酸接触
C.加热 D.与氯化钠接触
过氧化氢(H2O2)是一种无色粘稠液体,易分解为水和氧气,常用作氧化剂、漂白剂和消毒剂,为了贮存、运输、使用的方便,工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3?3H2O2),该晶体具有碳酸钠和过氧化氢的双重性质。接触下列物质不会使过碳酸钠失效的是( )
A、二氧化锰 B、硫酸铜 C、盐酸 D、氯化钠


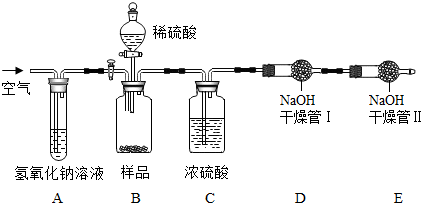 做菜用的一种嫩肉粉,其主要成分是碳酸氢钠.小明发现将拌了嫩肉粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气泡.他对此颇感兴趣,决定对其进行探究.
做菜用的一种嫩肉粉,其主要成分是碳酸氢钠.小明发现将拌了嫩肉粉的肉类放到锅中并加入食醋等调料烧煮时产生了大量气泡.他对此颇感兴趣,决定对其进行探究.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com