
题目列表(包括答案和解析)
Na2O2是一种淡黄色固体,能与H2O、CO2、HCl等物质反应。某兴趣小组结合化学课学习的内容,探究Na2O2能否和氢气反应。
(已知无水CuSO4是白色粉末,遇水变成蓝色,碱石灰是氢氧化钠固体与生石灰的混合物)
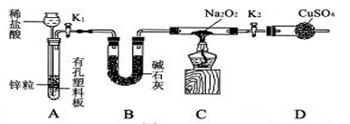
①按图组装仪器,(图中夹持仪器省略)
②检查气密性(气密性良好),装入药品Na2O2
③打开K1、K2,产生的氢气流经装有Na2O2 的硬质玻璃管,一段时间后没有任何现象;
④检验氢气的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末渐渐变成了白色固体,干燥管内的硫酸铜未变蓝色;
⑤反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1 。
请回答下列问题:
⑴B装置的作用 (填字母)。
A.吸收氢气中混有的氯化氢气体 B.吸收氢气携带的水蒸气
C.吸收装置A、B中空气中的二氧化碳
⑵步骤③目的是 。
⑶步骤⑤关闭K1后,将看到A装置中的现象
| |
⑷通过现象可知Na2O2能和氢气反应。请推测它们反应的生成物 (填字母)。
A. NaOH B. Na2CO3、H2O C. NaOH、H2O D. NaOH、O2
| 实验操作 | 实验现象 | 实验结论 |
| ①取3.00g变质的过氧化钠粉于一支大试管里,加入适量的水,共收集到0.32g气体,用______检验该生成的气体. | _______________. | 证明粉末中有Na2O2. |
| ②在①的反应液中加入足量的Ba(NO3)2溶液,充分反应. | 白色沉淀 | 证明粉末中有_____. |
| ③将②反应液过滤、洗涤、干燥和称量,得固体1.97g. | \ |
 “过氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量.
“过氧化钠(Na2O2)”是一种淡黄色固体,能与水或二氧化碳反应放出氧气.实验室有一瓶放置了较长时间的过氧化钠粉末,已知发生了部分变质,同学们取3.00g变质粉末决定探究其中的成分及其质量.| 实验步骤 | 实验现象 |
| ①取3.00g变质粉末于一支大试管内,加入适量的水,共收集到0.32g气体,然后用带火星木条检验生成的气体. | 固体完全溶解,______ |
| ②继续向上述试管中加入足量的石灰水,充分反应. | ______ |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体1.00g. |  |
| Na2O2 | NaOH | Na2CO3 | |
| 成分(填“有”或“没有”) | ______ | ______ | ______ |
| 质量(g) | ______ | ______ | ______ |
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量变质的过氧化钠粉末一支试管里,加入过量的水,然后用______检验该生成的气体. | ______ | 证明粉末中有Na2O2. |
| ②在①的剩余的溶液中加入足量的硝酸钡溶液,充分反应. | 产生白色沉淀 | 证明粉末中有______. |
| ③在①的剩余的溶液中加入足量的硫酸铜溶液. | ______ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com