
题目列表(包括答案和解析)
已知金属钠和水能发生下列反应:2Na+2H2O![]() 2NaOH+H2↑,现取金属钠4.6g投入到100g水中,
2NaOH+H2↑,现取金属钠4.6g投入到100g水中,
充分反应后,冷却到室温(20℃),得到一种不饱和溶液。向所
得溶液中逐滴滴入MgSO4溶液,实验测得溶液的总质量与滴入
MgSO4溶液的质量关系曲线如右图所示。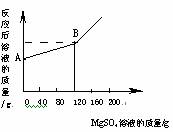
![]() 根据题意回答下列问题:
根据题意回答下列问题:
⑴金属钠和水充分反应后,生成氢气的质量为 g。
⑵图中A点的纵坐标表示的溶液的质量是 g。
⑶通过计算求出当滴入120gMgSO4溶液时,所得溶液中溶质的质量分数的多少?
(计算结果精确至0.1%)
“无土栽培”是一项利用化学试剂配成的营养液来栽培植物的新技术。下表是某实验小组的两种营养液的配方。请你回答有关问题:
| 配方Ⅰ | 配方Ⅱ |
| KCl 0.2g | KNO3 1.2g |
| KH2PO4 0.5g | Ca(NO3)2 1.4g |
| MgSO4 0.5g | (NH4)3PO4 0.3g |
| CaSO4 1.0g | MgSO4 0.6g |
| FeCl3 0.2g | |
| 备注:①各用2L水配制;②不用硬水配制 | |
(1)配方Ⅰ中属于复合肥料的物质是 ;
(2)判断所用的水是否是硬水的方法: ;
(3)从均衡养分的角度分析,选用 (填“配方Ⅰ”或“配方Ⅱ”)种植的同种植物在其他条件相同时长势会更好,其理由是 。
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 加入稀硫酸的质量 | 35g | 35g | 35g | 35g |
| 剩余固体的质量 | 8.6g | 7.4g | 6.2g | 5.6g |
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.5g |
| 第四次加入10g | 1.0g |
| 第五次加入10g | 0.6g |
| 第六次加入10g | 0.6g |
碱式碳酸铜[化学式为Cu2(OH)2CO3,相对分子质量为222]加热完全分解后得到的黑色固体是什么呢?甲、乙、丙三位同学想通过实验探究,来确定该黑色固体的组成。
(1)提出问题: 黑色固体是什么?
(2)猜想与假设: 黑色固体可能是:① ;②可能是炭粉;③可能是炭粉和氧化铜的混合物。请你补充猜想①。作出这些猜想的依据是 。
(3)实验方案: 他们称取了2.22g碱式碳酸铜在试管中高温加热使之完全分解,冷却至室温,称得黑色固体产物的质量为1.6g。
(4)实验反思:① 甲同学经过思考后,认为可以排除猜想③,理由是 (用化学方程式表示)。
② 乙同学根据质量守恒定律:化学反应前后,元素的种类和质量都不变。通过对得到的数据进行计算,排除了猜想②,他的理由是(通过计算式说明) 。
(5)实验结论:结合甲、乙同学的探究和查阅资料,丙同学确认只有猜想①成立。
(6)实验拓展:丙同学想进一步探究该黑色固体的化学性质。他发现实验室有一瓶无色溶液,其标签严重破损(如图),

老师告诉他该瓶试剂是硫酸、硫酸钠或硫酸镁溶液中的一种。他通过查阅资料得知常温下这三种物质的溶解度如下表:
|
物 质 |
H2SO4 |
Na2SO4 |
MgSO4 |
|
常温下的溶解度∕g |
与水以任意比互溶 |
18.0 |
39.0 |
丙同学根据以上信息,分析此溶液一定不是 溶液。为确定其成分,他取了少量黑色固体放入试管中,然后向其中滴加了一定量的该无色溶液后,发现黑色固体全部消失,溶液由无色变为蓝色。他确定该溶液为 。其反应的化学方程式为 。
【解析】初中阶段常见的黑色物质有:氧化铜、碳、二氧化锰、四氧化三铁等.然后根据化学反应前后元素种类不变,进行分析确定物质组成,(4)①碳具有还原性,能够和金属氧化物发生氧化还原反应,所以碳和氧化铜不能同时存在,②2.22g碱式碳酸铜含碳元素的质量为12/222×22.2g=0.12g≠1.6g,
(6)由标签可知:溶液的质量分数是20%,题中给出三种物种的溶解度,根据溶解度计算,在该温度下,饱和溶液中的溶质的质量分数,分析不可能的是什么.可能是什么;硫酸铜溶液是蓝色的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com