(2010?西宁)某兴趣小组对铁、锰(Mn)、铜的金属活动性顺序展开了探究.提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液.
请你参与并将以下内容补充完整:
提出假设:小组同学考虑到铁的活动性比铜强,对三种金属的活动性顺序提出如下假设.
假设l:锰>铁>铜 假设2:铁>锰>铜 假设3:
铁>铜>锰
铁>铜>锰
.
设计方案:
(1)验证假设l的实验方案是将锰片、铁片分别放入稀盐酸中,观察现象.
(2)假设2是否成立,小组同学提出了多种实验方案.
方案一是将锰片分别放入硫酸亚铁溶液和硫酸铜溶液中,观察现象;
方案二是
将锰片、铁片分别放入稀盐酸中,再取锰片放入硫酸铜溶液中,观察现象(或将铁片和铜片分别放入硫酸锰溶液中,观察现象)
将锰片、铁片分别放入稀盐酸中,再取锰片放入硫酸铜溶液中,观察现象(或将铁片和铜片分别放入硫酸锰溶液中,观察现象)
.
(3)验证假设3的实验方案是
将锰片放入硫酸铜溶液中,观察现象
将锰片放入硫酸铜溶液中,观察现象
.
实验及结论:小组同学通过实验交流后,确认假设1是成立的.验证假设1的实验现象是
都有气泡产生,锰片的反应比铁片的反应剧烈(或产生气泡的速率锰大于铁);
都有气泡产生,锰片的反应比铁片的反应剧烈(或产生气泡的速率锰大于铁);
.锰与盐酸反应的化学方程式为(反应中锰的化合价为+2价)
Mn+2HCl═MnCl2+H2↑
Mn+2HCl═MnCl2+H2↑
.
拓展研究:金属与酸的反应存在某种规律,请你分析下表中的数据,找到对应关系.
| 等质量(ag)的金属与足量盐酸反应 | 镁 | 铁 | 锰 |
| 金属的相对原子质量 | 24 | 56 | 55 |
| 产生氢气的质量(g) | a/12 | a/28 | a/27.5 |
| 找到的规律 | 等质量相同价态的金属与足量的酸完全反应,相对原子质量越大(小),产生的氢气的质量越少(多) 等质量相同价态的金属与足量的酸完全反应,相对原子质量越大(小),产生的氢气的质量越少(多) |

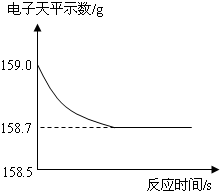 同学们采集了一些生铁样品(所含杂质既不溶于水也不与稀硫酸反应),采用电子天平进行分析.称得锥形瓶的质量为44.1g,生铁样品的质量为9g.在锥形瓶中加入足量稀硫酸后,电子天平记录数据如如图所示.请分析数据,回答
同学们采集了一些生铁样品(所含杂质既不溶于水也不与稀硫酸反应),采用电子天平进行分析.称得锥形瓶的质量为44.1g,生铁样品的质量为9g.在锥形瓶中加入足量稀硫酸后,电子天平记录数据如如图所示.请分析数据,回答