请你参与某学习小组的探究活动,并回答相关问题:
【发现问题】:小丽发现盛水的铁锅在与水面接触的部位最易生锈;
小茜发现自己的铜制眼镜框表面出现了绿色的铜锈;
小玲发现苹果切开不久,果肉上会产生一层咖啡色物质,好象生了“锈”一般.
【提出问题】:这三种物质“生锈”的原因是什么?
【收集证据】:(1)回忆已有知识:铁生锈的条件是
.
(2)查阅有关资料:“铜锈”主要成分是Cu
2(OH)
2CO
3(俗称铜绿);苹果“生锈”是果肉里的物质(酚和酶)与空气中的氧气发生了一系列的反应,生成咖啡色的物质.
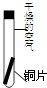
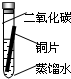
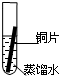
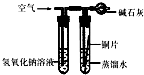
(3)实验探究:将四小块铜片分别按下图所示放置一个月,观察现象如下:
实验
装置 |
 |
 |
 |
 |
实验
现象 |
铜片不生锈 |
铜片不生锈 |
铜片不生锈 |
铜片生锈且水面
附近锈蚀最严重 |
由实验可知:铜生锈是铜与水、氧气、
等物质共同作用的结果.
【得出结论】:经过交流讨论,三位同学认为这些物质“生锈”除了可能与水有关外,还可能都与
(填物质名称)有关.
【反思与应用】利用所得结论填空:
①请你提出一条延长食品保质期的建议
.
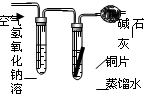
(4)再提出问题:“铜绿”受热分解后的产物是什么呢?设计与实验如图:
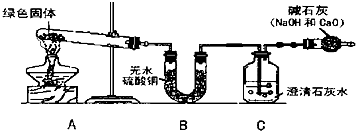
①对试管内的绿色固体加热,至完全分解.观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色(无水硫酸铜遇水变蓝),C装置中澄清石灰水变浑浊.
②取少量加热后生成的黑色固体于试管中,加入稀硫酸.观察到黑色固体逐渐溶解,溶液变成蓝色.
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝.观察到铁丝表面有红色物质析出.综上写出铜绿受热分解化学方程式:
.
④如果将B、C两装置对调,行吗?为什么?
,
.


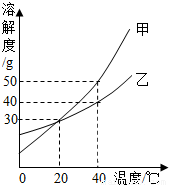
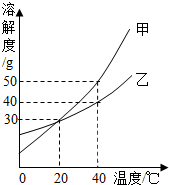 右图是甲、乙两种固体物质的溶解度曲线.
右图是甲、乙两种固体物质的溶解度曲线.