
题目列表(包括答案和解析)

某校化学课外活动小组的同学研究外界条件对水中氧气含量的影响。他们
利用仪器测得以下数据:
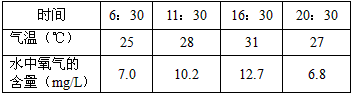
表1 某日的不同时间,长有水生植物的人工湖的水库
| 时间 | 6:30 | 11:30 | 16:30 | 20:30 |
| 气温(℃) | 25 | 28 | 31 | 27 |
| 水中氧气的 含量(mg/L) | 7.0 | 10.2 | 12.7 | 6.8 |
表2 某日同一时间,相距不远的四个地方的水样
| 地点 | 造纸厂的 排污口 | 菜市场的 下水道 | 家中 自来水 | 生长着植物 的人工湖 |
| 水中氧气的 含量(mg/L) | 0.2 | 1.2 | 5.0 | 11.8 |
请回答下列问题。
(1)分析表1中的数据可知:在其他条件相同的情况下, 随着温度的升高,氧气在水中的溶解能力_______(填“增强”或“减弱”)。
(2)分析表2中的数据可得出的结论是:__________________
_______________________________________________________。
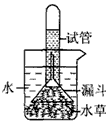
(3)为了验证结论,进行了右图所示的实验:
①实验时要通入一种气体,这种气体是_________;
②欲达到该实验的目的,装置必须放在有_________的环境中。
(4)若在家中饲养金鱼,提出给水增加氧气含量的方法:
______________________________________________(写一种即可)

以下是甲、乙两同学对有关镁与盐酸反应的系列研究
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1) 反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填“吸热”或“放热”)。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如下图所示,

则t1~t2时间内反应速率逐渐加快的主要原因是 。
研究二:反应后所得溶液的酸碱性探究:
【发现问题】
(1)反应后甲同学用pH试纸测定试管中溶液的酸碱性,发现pH小于7,
说明甲同学所得溶液呈 性(选填“酸”“碱”或“中”)。
(2)反应后乙同学的试管中镁条有剩余,向试液中滴入两滴酚酞溶液,振荡显红色,说明乙同学所得溶液呈碱性。对此现象,乙同学重复如上实验,得到同样结果。
【提出猜想】
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。
乙同学:猜想Ⅰ:氯化镁溶液使酚酞变红色; 猜想Ⅱ:镁与热水反应使酚酞变红色。
【实验与思考】
为验证猜想,甲、乙两同学均需测定________溶液的酸碱性,实验表明该溶液显弱酸性。
乙同学为完成猜想Ⅱ,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,请根据实验现象写出镁与水反应的化学反应方程式 。
【结论】
镁与稀盐酸反应,镁反应完全后所得溶液显酸性;
镁与稀盐酸反应,镁过量时所得溶液显碱性。
【拓展与延伸】
(1)金属氯化物的水溶液可能显中性或弱酸性,与金属的活动性顺序有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,氯化钾溶液显________性。
(2)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由此可见金属与水反应与金属的活动性顺序_________(填“有关”或“无关”)。
研究三: 金属活动性强弱与原子结构的关系:
下图为镁原子、钙原子和钡原子结构示意图,据此推测,这三种金属的活动性最强的是
__________________。

Mg Ca Ba
研究四:确定镁条的成分:
①称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
此镁条中金属镁的质量。(写出计算过程)
②反应后所得溶液中溶质的质量分数 。(计算结果保留一位小数)
【解析】研究一依据反应时温度的变化分析反应时能量的问题
研究二、
发现问题:依据酸碱性溶液pH的大小进行分析判断;
实验思考:根据甲乙同学的不同猜想分析两人必做的实验操作,以据反应的现象结合质量守恒定律的有关应用对化学方程式进行书写即可;
拓展延伸:(1)依据题目中有关的信息对相关物质的溶液酸碱性进行判断即可;
(2)根据活泼金属与水反应的条件分析即可;
研究三、根据钠镁活动性强弱的关系分析三种金属中活动性最强的物质即可.;
研究四①镁条表面被氧化生成MgO,它与硫酸反应不生成氢气.只有其中的镁单质与盐酸反应生成氢气.利用镁单质与盐酸反应的化学方程式和生成氢气的质量,列出比例式,就可计算出镁单质的质量和反应生成的氯化镁的质量,
②利用氧化镁与稀盐酸反应的化学方程式和氧化镁的质量,列出比例式,就可计算出与氧化镁反应生成的氯化镁的质量进行解答
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com