
题目列表(包括答案和解析)
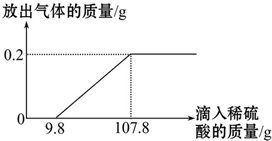 在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示.
在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示.
| 金属 | 稀硫酸 | 溶液温度/℃ | 金属消失时间/s | ||||
| 种类 | 质量/g | 形状 | 溶质质量分数/% | 体积/ml | 反应前 | 反应后 | |
| A | 0.10 | 丝 | 5 | 50 | 20 | 34 | 500 |
| B | 0.10 | 丝 | 5 | 50 | 20 | 40 | 100 |
| C | 0.10 | 粉末 | 5 | 50 | 20 | 35 | 50 |
| D | 0.10 | 丝 | 5 | 50 | 20 | 35 | 200 |
 (2012?常州)某研究性学习小组利用如图所示实验装置进行了以下探究实验.步骤如下:
(2012?常州)某研究性学习小组利用如图所示实验装置进行了以下探究实验.步骤如下:| 硫酸用量(mL) | 40 | 40 | 20 | 20 | 20 | 10 | 10 |
| 硫酸的溶质质量分数(%) | 9.8 | 39.2 | 9.8 | 19.6 | 39.2 | 19.6 | 39.2 |
| 收集所用时间 | 4′03 | 1′36 | 4′12 | 3′30 | 1′40 | 3′42 | 1′48 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com