
题目列表(包括答案和解析)
已知某混合金属粉末中除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计实验探究该粉末中铁、铜的存在。
资料在线:铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气
(2Al+2H2O+2NaOH=2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应。
可供选择的实验用品:烧杯、大试管、量筒、滴管、燃烧匙、药匙、磁铁;稀硫酸、稀盐酸、Na0H溶液、氨水。
请你参与并完成以下实验探究过程:
Ⅰ、提出假设 假设1:该混合金属粉末中除铝外还含有Fe。
假设2:该混合金属粉末中除铝外还含有 _________。
假设3:该混合金属粉末中除铝外还含有Fe、Cu。
Ⅱ、设计并实施实验方案
(1)基于假设1,不用化学试剂,证明金属铁的存在可用 ____________ 。
(2)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是
_____________,反应的化学方程式为 ___________。
(3)基于假设3,请你完成实验操作,描述实验现象。
| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再用滴管滴加 ,充分反应后,静置,弃去清液得到 固体。 | 固体粉末 , 并有 。 | 仅除去铝 |
| ② | 再往大试管中加 ,充分反应。 | 固体 , 溶液 。 | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
Ⅲ、已知该金属粉末的组成为铝和铁、铝和铜两种情况。
(1)为测定混合金属粉末中铝的质量分数,将5.6 g的金属粉末中加入100 g某溶质质量分数的稀硫酸,恰好完全反应,并产生a g氢气,则下列说法正确的是 ( )
A.当粉末为Al 、Fe时,a可能为0.2 g
B.当粉末为Al、Cu时,反应完全后,生成物的溶液里一定含有Al2(SO4)3和CuSO4
C.当粉末为Al、Cu时,若a为0.3g,则该种粉末中含铝的质量分数小于50%
D.当粉末为Al、Fe时,所需稀硫酸溶质质量分数一定大于9.8%
(2)若5.6 g粉末为铝和铜,加入97.6 g足量的稀硫酸,完全反应生成氢气0.3 g,求所得Al2(SO4)3溶液质量分数(Al2(SO4)3相对分子质量为342,要求有计算过程。
下面是实验室制取氧气的装置图,根据装置图回答下列问题:
|

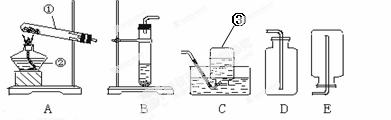
(1)写出装置图中标有①②③序号的仪器名称:
① ② ③
(2)实验室用高锰酸钾制取氧气时,可选用的气体发生装置是 (写出装置代号)。
该反应的化学方程式是  。
。
图A中用一团棉花放在靠近试管口的地方,目的是 。
。
图A中试管口要略向下倾斜,目的是: 。
(3)实验室用加热高锰酸钾制取氧气时,如果用排水法集气时,当观察气泡 放出时就可以收集。当停止反应时,如果先熄灭酒精灯,再把导管从水槽里撤出,造成的后果是 。
(4)如果用D 收集氧气,检验氧气是否收集满的方法是: 。
收集氧气,检验氧气是否收集满的方法是: 。
(5)实验室常用过氧化氢溶液和二氧化锰制取氧气,选用的气体发生装置是 (写出装置代号)。该反应的化学方程式是 
 。
。
(6)实验室常用加热无水醋酸钠和碱石灰的固体混合物制取甲烷气体,已知甲烷密度比空气小,难溶于水,则制取并收集甲烷的实验装置可以选择
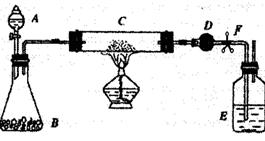 某课外活动小组加热氧化铜和炭粉(过量)的混合物,得到的铜粉中含有炭粉,他们用下图所示的装置,对获得的铜粉样品进行实验分析.以定样品中铜的质量分数。(图中铁架台等装置已略去。)已知,过氧化氢在二氧化锰的催化作用下分解产生氧气。请你帮他们完成实验报告。
某课外活动小组加热氧化铜和炭粉(过量)的混合物,得到的铜粉中含有炭粉,他们用下图所示的装置,对获得的铜粉样品进行实验分析.以定样品中铜的质量分数。(图中铁架台等装置已略去。)已知,过氧化氢在二氧化锰的催化作用下分解产生氧气。请你帮他们完成实验报告。
(1)实验过程:
| 编号 | 实验步骤 | 实验现象 | 有关化学方程式 |
| a | 连接好仪器后,打开止水夹F.检查 气密性(观察).在C中加入样品粉末 Wg,在D中装入药品后称最为m1g | ||
| b | 打开A的活塞,慢慢滴加溶液 | ||
| c | 对C进行加热当C中药品充分反应 后,关闭A的活塞、关F,停止加热 | ||
| d | 冷却后,称得D的质量为m2g |
(2)计算:
样品中铜的质量分数= (用含w、m1、m2的代数式表示)
(3)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C中反应完全,D中吸收完全,也
不会得出正确的结果。经时论,有同学提出在B与C之间加入一个装置。再次实验后.得
到了较正确的结果,那么,原来实验所测得的铜的质量分数偏小的原因可能是
在B与C之间加入的装置可以是 ;
其中盛放的药品是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com