
题目列表(包括答案和解析)
某化工集团出售的小苏打样品NaHCO3的质量分数的标注≥95%,某化学兴趣小组的同学对此产生了疑问,进行了下面的实验:向盛有13g小苏打固体样品(所含杂质不溶于水也不与酸反应)的烧杯中,加入100.5g硫酸溶液恰好反应。反应过程用精密仪器测得烧杯连同药品的质量与反应时间的关系如表所示。烧杯连同药品的起始质量为200.0g。反应的化学方程式为:![]()
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质的总质量/g | 200.0 | 196.7 | 194.6 | 193.9 | 193.4 | M | 193.4 |
回答下列问题:
(1)该小组因故没有记录反应时间为5min时的数据M。你由表中数据推测M=___________g。
(2)当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为___________g。
(3)该小苏打样品中NaHCO3的质量分数为多少?是否合格?(计算结果精确到0.1%)
(4)求实验结束后溶液中溶质的质量分数?
某盐场生产的工业盐产品质量指标如右图:为了测定该工业用盐中氯化钠的质量分数是否符合产品质量指标,进行如下实验:
①取100g该工业盐加热烘干,测得水的质量为3.36g,
②另取100g该工业盐溶于水中加入足量碳酸钠溶液得到碳酸钡沉淀1.97g, 
(反应方程式为![]() :BaCl2+Na2CO3===BaCO3↓+2NaCl)
:BaCl2+Na2CO3===BaCO3↓+2NaCl)
求:(![]() 1)100g该工业盐中含氯化钡的质量。
1)100g该工业盐中含氯化钡的质量。
(2)通过计算,判断该工业盐中氯化钠的质量分数是否符合产品质量指标。
右图是某种工业用盐的产品质量指标,为了测试该工业用盐中NaCl的质量分数,取100g该工业用盐进行实验①用碳酸钠来测定杂质氯化钙的质量时,等到0.937g沉淀 ②测得这种盐中含水份3.36%

求 :(1)100g该工业用盐中含氯化钙的质量
(2)通过计算判定该工业用盐是否符合产品质量标准
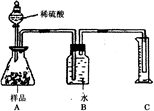 烧碱是常用的消毒剂,因烧碱价廉而被广泛地应用,工业烧碱中常常因含有Na2CO3杂质而不纯.甲、乙两同学设计实验来探究工业烧碱中NaOH的质量分数.
烧碱是常用的消毒剂,因烧碱价廉而被广泛地应用,工业烧碱中常常因含有Na2CO3杂质而不纯.甲、乙两同学设计实验来探究工业烧碱中NaOH的质量分数.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com