
题目列表(包括答案和解析)
某制碱厂以海水为主要原料生产纯碱(碳酸钠)和其他副产品.
(一)将海水进行处理后获得精盐水.海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质.其处理的主要流程如下:
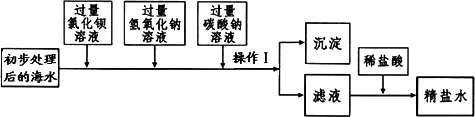
(1)加入氢氧化钠溶液的目的是________.
(2)操作Ⅰ的名称是________.
(3)操作1所得的沉淀是混合物,其成分有:BaSO4、Mg(OH)2、________(填化学式).
(4)向滤液中滴加适量稀盐酸的目的是________.
(二)将精盐水制成饱和溶液,先向其中通入足量的氨气,再向其中通入足量的二氧化碳至有大量晶体(碳酸氢钠,NaHCO3)析出,反应的化学方程式为NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓;将晶体转移出来后,加热至不再有气体产生,所得固体即为纯碱.
(1)加热晶体碳酸氢钠获得纯碱的化学方程式为________.
(2)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀,根据上述实验可确定纯碱样品含有杂质________(写化学式).
(三)为测定上述方法获得的纯碱产品中碳酸钠的纯度.某研究性学习小组对纯碱产品进行检测.取22克该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断振荡.通过查阅资料得知,在滴加盐酸过程中首先发生的反应是:Na2CO3+HCl=NaHCO3+NaCl;然后发生的反应是:NaHCO3+HCl=NaCl+H2O+CO2↑.在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示:.
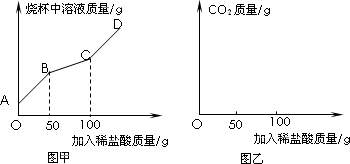
(1)某同学认为,在上述纯碱含量测定过程中,用玻璃棒不断搅拌,能使测定误差减小,其理由是________.
(2)请你根据图甲提供的信息,在图乙的坐标系中画出检测过程中产生CO2的质量随滴加盐酸质量的变化曲线.(标明二氧化碳质量的相应数值)
(3)计算该样品中纯碱的质量分数(写出计算过程).

| ||
| ||



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com