空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
测定时刻
| 5∶05
| 5∶10
| 5∶15
| 5∶20
| 5∶25
| 5∶30
| 5∶35
|
pH
| 4.95
| 4.94
| 4.94
| 4.88
| 4.86
| 4.85
| 4.85
|
分析上述数据变化,你可以得出的结论是
;针对此结论,你猜测其中的原因为
。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO
2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
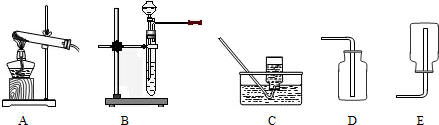
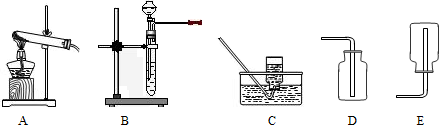
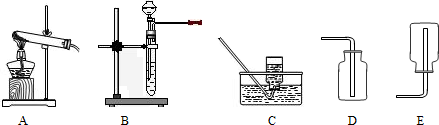
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________
,
若发现________________,说明装置C气密性良好。
(2)实验室用Na
2SO
3固体和硫酸溶液制取SO
2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是
。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H
2S气体,反应的方程式为_________________
。
(4)SO
2气体通过D装置时现象是____________________
,通过E装置时现象是________________
;SO
2与H
2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是
。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
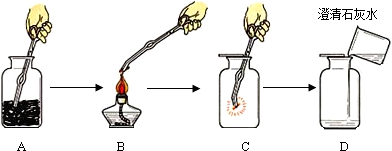
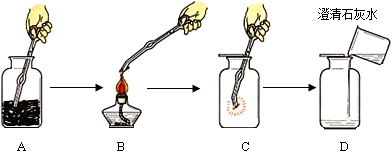
(三)⑴为测定某地方的空气中SO
2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO
2含量,反应方程式是:SO
2+I
2+2H
2O=H
2SO
4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO
2含量和可吸入颗粒的含量,除测定气体流速(单位:cm
3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和
。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中,
;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100 mL。
⑵乙同学拟用下列简易装置测定空气中的SO
2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(
n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO
2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO
2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J

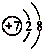 可知,氮原子最外层电子数目为
可知,氮原子最外层电子数目为