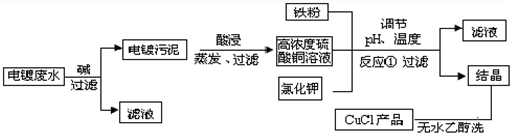
氯化亚铜在有机合成工业中常作催化剂.它是一种白色,微溶于水、不溶于酒精,易溶于酸.见光易分解,易与空气中氧气反应的物质.以下是从含Cu
2+、Fe
3+等的电镀废水中制备氯化亚铜的工艺流程图.
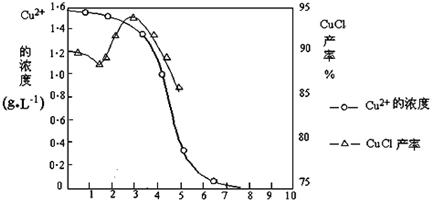
下图是滤液中Cu
2+的含量与pH的关系及CuCl产率与pH的关系图.
请回答以下问题:
(1)由反应①制备CuCl时的最佳pH在
3.5
3.5
左右;
(2)反应①在隔绝空气条件下进行时CuCl产率较高的原因是
易与空气中氧气反应
易与空气中氧气反应
,根据其见光易分解的性质,氯化亚铜应保存在
棕色瓶
棕色瓶
的试剂瓶中.
(3)在电镀废水中加入碱的目的是
将Cu2+、Fe3+转化为氢氧化铜和氢氧化铁沉淀
将Cu2+、Fe3+转化为氢氧化铜和氢氧化铁沉淀
.欲得到高纯度氯化亚铜,在电镀污泥中加酸时,pH应控制在
4.1与4.7之间
4.1与4.7之间
,发生的化学反应方程式为
Cu(OH)2+H2SO4=CuSO4+2H2O.
Cu(OH)2+H2SO4=CuSO4+2H2O.
.已知氢氧化铁和氢氧化铜沉淀的pH(见下表).
| 物质 |
开始沉淀 |
沉淀完全 |
| 氢氧化铜 |
4.7 |
6.7 |
| 氢氧化铁 |
1.5 |
4.1 |
(4)反应①中生成硫酸亚铁、硫酸钾等物质,请写出化学反应方程式:
2CuSO4+Fe+2KCl=2CuCl↓+FeSO4+K2SO4
2CuSO4+Fe+2KCl=2CuCl↓+FeSO4+K2SO4
;
(5)从滤液中制得晶体的实验操作为:蒸发浓缩、
加入酸调整溶液pH在3.5 左右使氯化亚铜成为沉淀析出
加入酸调整溶液pH在3.5 左右使氯化亚铜成为沉淀析出
、
过滤
过滤
、洗涤、干燥;
(6)用酒精洗涤晶体得到产品的优点是
防止氯化亚铜溶于水
防止氯化亚铜溶于水
.


